A large-scale survey of the bacterial communities in lakes of western Mongolia with varying salinity regimes
2
2020
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
... 3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
Planctomycetes as a vital constituent of the microbial communities inhabiting different layers of the meromictic lake S?lenvannet (Norway)
2
2020
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
... [2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
Factors affecting seasonal variation of microbial community structure in Hulun Lake, China
2
2022
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Characteristics of planktonic bacteria community between summer and winter surface water in Dali Lake
1
2021
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
达里湖表层水体浮游细菌群落结构的夏-冬季节差异
1
2021
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
Changes in the bacterioplankton community between “ice” and “water” in the frozen Dali Lake
1
2021
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
冰封状态下达里湖冰-水中浮游细菌群落结构差异
1
2021
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
Characteristics of the bacterioplankton community and their relationships with water quality in Chishui River basin
1
2021
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
赤水河流域浮游细菌群落特征及其与水质的关系
1
2021
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
Salinity reduces bacterial diversity, but increases network complexity in Tibetan Plateau lakes
2
2019
... 自然生态系统是动植物和微生物的“蓄水池”,其内部的生物与水生态系统相互依存、相互联系[1-2].其中,微生物是地球上分布最广、代谢效率高、适应性强的古老生物群体,它们在生物界发挥着极其重要的作用,是健康的水生态系统的基础[3].在全球范围内,湖泊是水生生态系统的重要组成部分,总面积约为2.0587×106 km3,占全球大陆面积的1.5%,总水量约为1.764×105 km3[1].湖泊作为生命的基本生活环境之一,影响着自然生态系统的结构[2].在湖泊微生物当中,浮游细菌作为其重要的组成部分,在湖泊水体中物质能量循环和信息传递以及地球化学循环中发挥着重要的作用[4].浮游细菌群落结构在湖泊生态系统中高度可变,浮游细菌群落对湖泊水体中环境因子的变化也较为敏感[5].湖泊中有机物的浓度和类型、食物网的组成和浮游细菌间的相互作用等均对浮游细菌的群落组成有影响[6-7].因此,研究湖泊中浮游细菌群落的分布格局及外界环境因素对其的驱动机制对了解和完善湖泊中浮游细菌群落的生态过程有十分重要的意义. ...
... 青藏高原被称为“第三极”,是地球上最大的高原(2×106 km2)和最高的高原(平均海拔4 500 m)[7,22],也是世界上高海拔湖泊数量最多的地区.青藏高原湖泊平均海拔4 000 m以上,总面积为(4 3151.08±411.49) km2[23].青藏高原湖泊主要以高盐度湖泊和季节性或常年冰盖的层状湖泊为主[24],且具有出现/消失和扩张/收缩的特征,是气候变化的敏感指标[23-24]. ...
Bacterial diversity and morphology in deep ultraoligotrophic Andean lakes: role of UVR on vertical distribution
1
2009
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Environmental interpretation of spatial variation of planktonic bacterial communities in the North Canal River
1
2021
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
北运河浮游细菌集合群落空间变化的环境解释
1
2021
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Bacterial community structure in Baiyangdian Lake in summer and its relationship with environmental factors
1
2021
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
白洋淀水域夏季细菌群落结构及与环境因子的关系
1
2021
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Bacterial diversity in surface sediments of Baiyangdian Lake and its influencing factors
0
2021
白洋淀表层沉积物细菌多样性及影响因素
0
2021
Bacterial community structure and diversity in Chaohu Lake
0
2018
Spatial and temporal distribution characteristics of bacterioplankton community structure in the downstream of Pearl River
1
2020
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
珠江下游浮游细菌群落结构的时空分布特征
1
2020
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Bacteria in the lakes of the Tibetan Plateau and polarregions
1
2020
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Bacterial diversity of plankton and sediment in plateau lake
1
2020
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
高原湖泊浮游、沉积物细菌多样性研究
1
2020
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Bacterial diversity in the soil surrounding the karst plateau lakes in Guizhou
1
2019
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
环贵州喀斯特高原湖泊环境中的细菌多样性
1
2019
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
An review on research of bacteria community structure in lakes on Qinghai-Tibet Plateau
1
2013
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
青藏高原湖泊细菌种群结构的研究综述
1
2013
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Microbial community structures in the Nam Co lake, Tibetan Plateau, and comparison with other alpine lakes
7
2008
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
... [18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
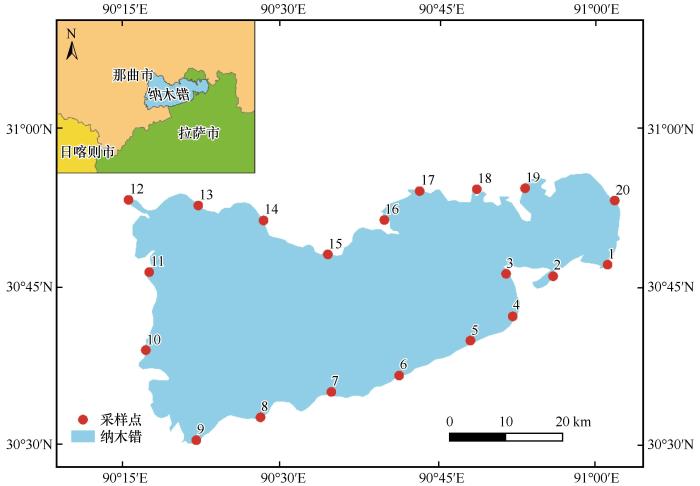
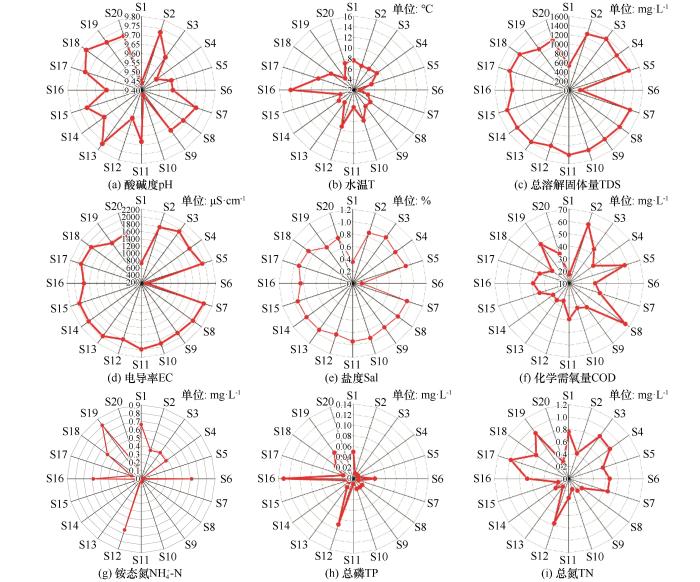
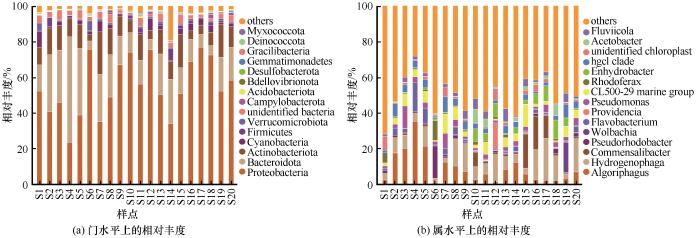
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... [18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... [18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
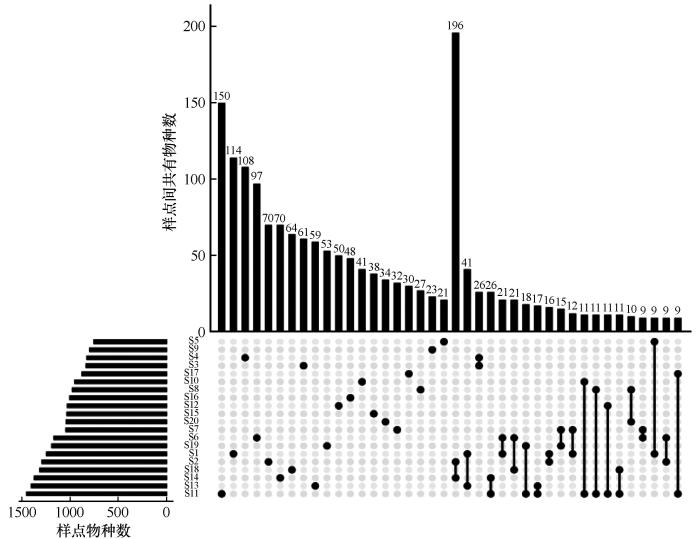
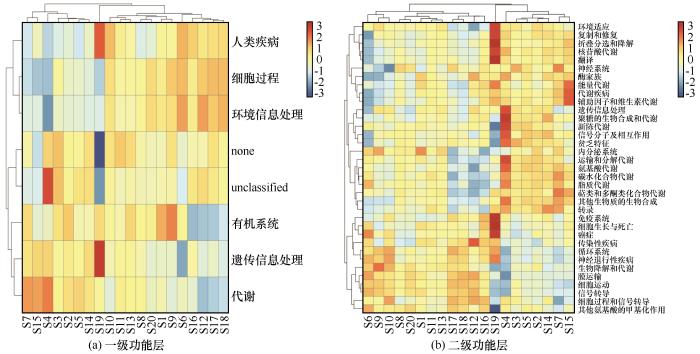
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
青藏高原纳木错湖细菌群落特征及其与高山湖泊的对比
7
2008
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
... [18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... [18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... [18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Bacterial community of the largest oligosaline lake
6
2010
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... -19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... -19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
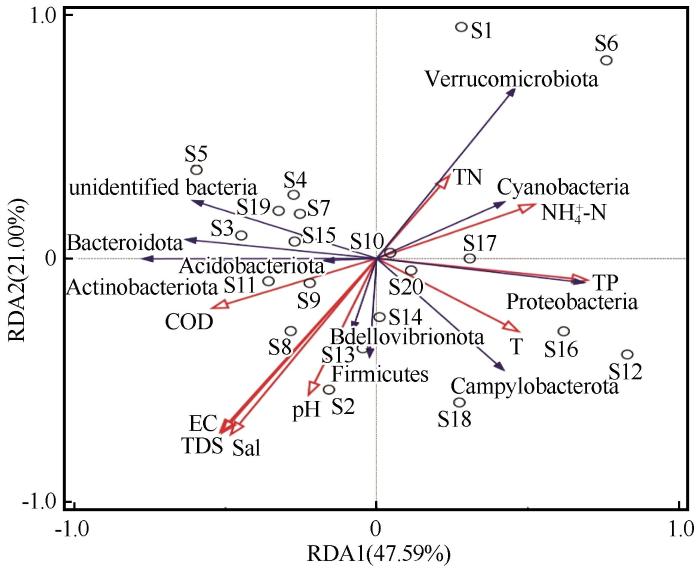
... 水体理化特性对于浮游细菌群落组成具有较大的影响[44-45],冗余分析结果显示TDS和Sal是显著影响纳木错浮游细菌群落分布的环境因子(P<0.01),这与Liu等[19]在2010年研究的结果不同.研究表明,TDS通过影响水体的透明度,来影响水体中以光能作为能源的硝化和反硝化类细菌的繁殖.当TDS升高时,浊度随之升高,水体透明度降低,导致水体中浮游细菌能够接受到的光照强度减弱,从而导致水体中硝化和反硝化细菌生物量减少;反之,当TDS降低时,水体中光照充足,从而促进了水体中浮游细菌群落的繁殖[44].在本研究中发现,多类浮游细菌群落与TDS浓度呈明显的正相关关系,造成这种现象的原因可能与纳木错处于青藏高原这一地理环境有关,这与处于低海拔的湖泊有差异.纳木错水的一部分来源于冰川融水,水体本身TDS值较小,再加上外界的干扰很小,浑浊度小,湖水清澈.推测可能是当水体TDS值较低时,小范围的升高并不会影响浮游细菌的繁殖效率;相反,当TDS本身处于临界值左右时,在一定范围内的增加可能会对细菌的增长产生影响. ...
Prokaryotic community structure driven by salinity and ionic concentrations in plateau lakes of the Tibetan Plateau
1
2016
... 目前,对于湖泊中浮游细菌群落特征及其与环境因子相互关系的研究已广泛开展.如Shang等[3]探索呼伦湖不同季节水体细菌群落及其影响因素,得出浮游细菌群落在淡水生态系统水质调控和生物地球化学循环中起着重要作用.Corno等[8]通过研究URV(紫外线)对Andean湖泊水体环境的影响,进而得出紫外线对其中浮游细菌群落结构有影响.靳燕等[9]研究了浮游细菌集合群落中核心分类操作单元和特有分类操作单元是否具有相同的环境选择模式这一问题,发现核心分类操作单元和特有分类操作单元的环境选择模式具有较大差异.部分学者[10-13]对水体中以及沉积物中的浮游细菌群落结构特征及影响因素进行了分析,结果显示,不同的环境因子,如pH、溶解氧含量(DO)、化学需氧量(COD)、营养元素(如总磷TP、总氮TN)等,对浮游细菌群落结构影响较大.然而,相对于这些研究区域,中国青藏高原有全国最大的湖泊群,面积占全国湖泊面积的45%以上,青藏高原具有温度低、养分利用率低、远离人为干扰等特点,这些特征使这个区域的湖泊成为研究区域和全球尺度上浮游细菌分布模式的独特自然实验室[14].近年来,对于青藏高原湖泊浮游细菌的研究也逐渐增多,刘桦聪[15]、邓阳等[16]、李明等[17]分别采用纯培养和免培养等方法对青藏高原上湖泊细菌种群结构多样性进行了研究,发现在青藏高原上湖泊中有大量的细菌群落.刘晓波等[18]、Liu等[19]分析了纳木错表层水体细菌的丰度,发现细菌丰度与叶绿素a(chla)浓度呈显著相关.因此,在有重要生态环境意义的高原湖泊开展浮游细菌结构变化研究,可为不同气候条件下的湖泊水体生态系统演变对比提供基础数据,可为深入探讨全球生态环境演变提供理论基础[20]. ...
Characteristics of bacterioplankton community with relations to environmental parameters in upstream and midstream of the Luanhe River, China
1
2022
... 基于以上分析,本文以青藏高原湖泊纳木错作为研究对象,于2021年在纳木错沿岸进行样品的采集,结合样品理化指标参数的测试,通过16S rDNA扩增子测序分析技术[21],对纳木错沿岸水体浮游细菌群落组成、优势细菌门类进行分析,讨论纳木错沿岸水体浮游细菌群落结构对水体理化指标参数变化的响应关系,对浮游细菌生态功能进行初步探讨,以实现对高原湖泊水体浮游细菌群落组成以及浮游细菌群落对外部环境变化响应过程的分析. ...
滦河干流中上游浮游细菌群落多样性及其影响因素
1
2022
... 基于以上分析,本文以青藏高原湖泊纳木错作为研究对象,于2021年在纳木错沿岸进行样品的采集,结合样品理化指标参数的测试,通过16S rDNA扩增子测序分析技术[21],对纳木错沿岸水体浮游细菌群落组成、优势细菌门类进行分析,讨论纳木错沿岸水体浮游细菌群落结构对水体理化指标参数变化的响应关系,对浮游细菌生态功能进行初步探讨,以实现对高原湖泊水体浮游细菌群落组成以及浮游细菌群落对外部环境变化响应过程的分析. ...
Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau
1
2012
... 青藏高原被称为“第三极”,是地球上最大的高原(2×106 km2)和最高的高原(平均海拔4 500 m)[7,22],也是世界上高海拔湖泊数量最多的地区.青藏高原湖泊平均海拔4 000 m以上,总面积为(4 3151.08±411.49) km2[23].青藏高原湖泊主要以高盐度湖泊和季节性或常年冰盖的层状湖泊为主[24],且具有出现/消失和扩张/收缩的特征,是气候变化的敏感指标[23-24]. ...
Water Environmental characteristics and water quality assessment of lakes in Tibetan Plateau
2
2022
... 青藏高原被称为“第三极”,是地球上最大的高原(2×106 km2)和最高的高原(平均海拔4 500 m)[7,22],也是世界上高海拔湖泊数量最多的地区.青藏高原湖泊平均海拔4 000 m以上,总面积为(4 3151.08±411.49) km2[23].青藏高原湖泊主要以高盐度湖泊和季节性或常年冰盖的层状湖泊为主[24],且具有出现/消失和扩张/收缩的特征,是气候变化的敏感指标[23-24]. ...
... [23-24]. ...
青藏高原湖泊水环境特征及水质评价
2
2022
... 青藏高原被称为“第三极”,是地球上最大的高原(2×106 km2)和最高的高原(平均海拔4 500 m)[7,22],也是世界上高海拔湖泊数量最多的地区.青藏高原湖泊平均海拔4 000 m以上,总面积为(4 3151.08±411.49) km2[23].青藏高原湖泊主要以高盐度湖泊和季节性或常年冰盖的层状湖泊为主[24],且具有出现/消失和扩张/收缩的特征,是气候变化的敏感指标[23-24]. ...
... [23-24]. ...
Bacterial diversity and community composition distribution in cold-desert habitats of Qinghai-Tibet Plateau, China
2
2021
... 青藏高原被称为“第三极”,是地球上最大的高原(2×106 km2)和最高的高原(平均海拔4 500 m)[7,22],也是世界上高海拔湖泊数量最多的地区.青藏高原湖泊平均海拔4 000 m以上,总面积为(4 3151.08±411.49) km2[23].青藏高原湖泊主要以高盐度湖泊和季节性或常年冰盖的层状湖泊为主[24],且具有出现/消失和扩张/收缩的特征,是气候变化的敏感指标[23-24]. ...
... -24]. ...
Lake ice phenology of the Nam Co at Tibetan Plateau: remote sensing and modelling
1
2022
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
青藏高原纳木错湖冰物候变化遥感监测与模拟
1
2022
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
Characteristics and effective factors of bacterial community in surface water along the coast of Namtso lake
1
2022
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
纳木措湖沿岸表层水细菌群落特征及影响因素
1
2022
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
Lake ecosystem health assessment using a novel hybrid decision-making framework in the Nam Co, Qinghai-Tibet Plateau
1
2022
... 纳木错位于青藏高原东南部,属半湿润半干旱地带,有充足的光、热以及水资源,气压比较低,是中国第三大的咸水湖[18].湖面海拔4 718 m,面积约1 961 km²,最大水深达120 m以上[18-19].纳木错是念青唐古拉山西北侧大型断陷洼地中的构造湖泊,属于内流湖泊[25].据计算,每年进入湖泊的冰川融水为1.24×109 m3,降水径流为1.345×1010 m3[26-27]. ...
Characteristics of culturable bacterial community in coastal water of lake Nam Co in spring
3
2022
... 利用便携式多参数水质检测仪现场测定水温(T)、pH、电导率(EC)、盐度(Sal)和总溶解固体量(TDS).其他指标,如总氮(TN)、总磷(TP)、化学需氧量(COD)和铵态氮(NH4+-N)等,送水样至西藏博远科技环境检测有限责任公司进行实验室测定.其中总磷(TP)和总氮(TN)的测定分别是用钼酸铵分光光度法和碱性过硫酸钾消解紫外分光光度法;铵态氮(NH4+-N)用纳氏试剂分光光度法进行测定;化学需氧量(COD)采用重铬酸钾法进行测定[28]. ...
... 采用SDS法提取基因组DNA,用1%琼脂糖凝胶检测DNA浓度和纯度.对16S rDNA基因的V4高突变区片段进行PCR扩增.引物序列为R∶806R(5′-GGACTACHVGGGTWTCTAAT-3′)和F∶515F (5′-GTGCCAGCMGCCGCGGTAA-3′)[28].PCR反应均使用15 μL Phusion® highfidelity PCR Master Mix (New England Biolabs)进行,步骤为98 ℃预变性1 min,98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,一共30个循环.最后在72 ℃下保温5 min.PCR扩增产物检测利用的是2%琼脂糖凝胶电泳,PCR产物的回收使用Qiange公司的凝胶回收试剂盒.使用TruSeq® DNA PCR-Free Sample Preparation Kit生成文库,构建好的文库经过Qubit和Q-PCR定量,文库合格后,委托北京诺禾致源科技股份有限公司在NovaSeq 6000平台上进行测序. ...
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
纳木措春季沿岸水体可培养细菌群落特征
3
2022
... 利用便携式多参数水质检测仪现场测定水温(T)、pH、电导率(EC)、盐度(Sal)和总溶解固体量(TDS).其他指标,如总氮(TN)、总磷(TP)、化学需氧量(COD)和铵态氮(NH4+-N)等,送水样至西藏博远科技环境检测有限责任公司进行实验室测定.其中总磷(TP)和总氮(TN)的测定分别是用钼酸铵分光光度法和碱性过硫酸钾消解紫外分光光度法;铵态氮(NH4+-N)用纳氏试剂分光光度法进行测定;化学需氧量(COD)采用重铬酸钾法进行测定[28]. ...
... 采用SDS法提取基因组DNA,用1%琼脂糖凝胶检测DNA浓度和纯度.对16S rDNA基因的V4高突变区片段进行PCR扩增.引物序列为R∶806R(5′-GGACTACHVGGGTWTCTAAT-3′)和F∶515F (5′-GTGCCAGCMGCCGCGGTAA-3′)[28].PCR反应均使用15 μL Phusion® highfidelity PCR Master Mix (New England Biolabs)进行,步骤为98 ℃预变性1 min,98 ℃变性10 s,50 ℃退火30 s,72 ℃延伸30 s,一共30个循环.最后在72 ℃下保温5 min.PCR扩增产物检测利用的是2%琼脂糖凝胶电泳,PCR产物的回收使用Qiange公司的凝胶回收试剂盒.使用TruSeq® DNA PCR-Free Sample Preparation Kit生成文库,构建好的文库经过Qubit和Q-PCR定量,文库合格后,委托北京诺禾致源科技股份有限公司在NovaSeq 6000平台上进行测序. ...
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Community structure of bacterioplankton and its relationship with environmental factors in the upper reaches of the Heihe River in Qinghai Plateau
3
2021
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... [29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
... [29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Community structure of planktonic bacteria and its driving factors along the upstream area of Qingjiang River in Lichuan City, Hubei Province
1
2020
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
清江上游利川段浮游细菌群落结构特征及其影响因素
1
2020
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Biphasic cellular adaptations and ecological implications of Alteromonas macleodii degrading a mixture of algal polysaccharides
1
2019
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Spatial and temporal changes of bacterioplankton community and function in Zhejiang and Fujian coastal ecological pasture technology demonstration areas
1
2022
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
浙闽沿海生态牧场技术示范区浮游细菌群落和功能的时空变化
1
2022
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Genetic diversity and composition of bacterial community in water of Poyang Lake
1
2009
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
鄱阳湖水体细菌群落组成及遗传多样性
1
2009
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Characteristics of bacterial communities and their co-occurrence networks in lake ecosystem with different trophic states
1
2020
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
不同营养程度湖泊中细菌群落组成及其分子生态网络特征
1
2020
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Microbial diversity in water and sediment of Lake Chaka, an athalassohaline lake in northwestern China
1
2006
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
Spatial distribution of bacterioplankton community in Hongchaojiang Reservoir and its relationship with environmental factors
1
2020
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
洪潮江水库浮游细菌群落空间分布及其与环境因子的关系
1
2020
... 纳木错浮游细菌群落结构组成显示,在门水平上,变形菌门、拟杆菌门、放线菌门是优势类群,与盐湖生态系统中的典型类群一致,并符合湖泊等咸水水体中浮游细菌群落组成的规律[28-29].变形菌门作为纳木错中分布最广泛的细菌类群,在6号、12号和17号变形菌门的含量均在75%以上.研究发现,变形菌门的适应能力较强,它可以利用水中的氮和磷等污染物,常被作为污水处理厂活性污泥系统中的主要菌群[30].在纳木错中,变形菌门的优势类群为γ-变形菌和α-变形菌.γ-变形菌是主要脱氮菌群之一,可以作为去除水体中过量氮元素的菌群[29].研究还发现,γ-变形菌还是冷适应细菌,纳木错由于其特殊的地理环境、低温和高海拔,以及青藏高原经历了显著的氮(N)沉积和降水增加,这导致了大量的冷适应γ-变形菌的积累[29,31-32].α-变形菌含量也较高,研究发现,这类细菌主要生存在寡营养型湖泊当中,纳木错属于寡营养型湖泊[18-19],为这类细菌的生存提供了适宜环境[33].本研究发现,在纳木错中β-变形菌含量较低,而之前研究表明β-变形菌在极端贫瘠的湖泊中十分罕见,主要生存在富营养性的湖泊当中[34].纳木错属于贫营养性湖泊[18-19],推测这可能导致β-变形菌群落分布较少的原因之一.拟杆菌门作为纳木错第二大优势菌群,拟杆菌门是盐湖中的主要类群[35],根据纳木错盐度的大小,可知纳木错属于盐湖[18-19],这为拟杆菌门提供了良好的生存环境,导致其在纳木错中含量较高.放线菌门作为纳木错中的第三大类群.一般生存在碱性湖泊当中,纳木错的pH值为9.49,属于碱性湖泊,适宜放线菌门生存.放线菌门可以利用葡萄糖,具有异养硝化作用,在营养和能量循环中起着关键作用[36]. ...
A novel psychrotrophic, solvent tolerant Pseudomonas putida SKG-1 and solvent stability of its psychro-thermoalkalistable protease
1
2011
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Predictive functional profiling of microbial communities using 16S rRNA marker gene sequences
1
2013
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Hydrogenophaga defluvii sp. nov. and Hydrogenophaga atypica sp. nov., isolated from activated sludge
1
2005
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Isolation and characterization of a biphenyl-utilizing psychrotrophic bacterium, Hydrogenophaga taeniospiralis IA3-A, that cometabolize dichlorobiphenyls and polychlorinated biphenyl congeners in Aroclor 1221
1
2006
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Diversity and bioprospective potential (cold-active enzymes) of cultivable marine bacteria from the subarctic glacial Fjord, Kongsfjorden
1
2014
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Impact of tail water discharged on bacterial community structure in river in different seasons
1
2018
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
不同季节尾水排放对河道细菌群落结构的影响
1
2018
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Phylogenetic shifts of bacterioplankton community composition along the Pearl Estuary: the potential impact of hypoxia and nutrients
1
2015
... 在属水平上,高通量测序结果显示,噬氢菌属和嗜冷菌属含量较高,这与刘晓波等[18]在2008年对纳木错水体浮游细菌群落研究结果有所不同.推测可能是纳木错的环境条件的变化对纳木错浮游细菌群落组成长产生了较大影响,导致水体浮游细菌群落结构发生了变化[37-38].噬氢菌属的细菌能够利用氢氧化物作为能源和碳源,部分种类有分解高分子有机物的功能,部分种具有耐寒和嗜寒的特征,在河口沉积物及南北极等多种环境中都分离出该属的细菌[39];在加拿大低温土壤中也发现存在噬氢菌属细菌,它可以在低温环境下将联苯作为主要的碳源[40];Prasad等[41]曾在研究北极地区Kongsfjorden海湾细菌多样性和生态功能时发现,嗜冷菌属不仅存在耐冷环境中,在盐度较高的环境中也有该类细菌的相关报道,还发现这类细菌还可能会产生脂肪酶等一系列产物.hgclclade和CL500-29 marine group也为优势类群.有研究表明,hgclclade和CL500-29 marine group较为适宜在高营养盐水体中生长和繁殖,这两类细菌与浮游植物之间关系密切,尤其和蓝藻联系紧密[42].但本研究却发现这两类菌属与营养盐之间没有正相关关系,导致这一类现象的原因可能和纳木错所处的高寒、低氧等特殊生境有关系.hgclclade对低氧环境具有耐受性,能够利用水体中的低浓度溶解有机碳,对水体的净化有重要作用[43]. ...
Bacterioplanktonic community’s structure and their influencing factors in the Pearl River Estuary
2
2019
... 水体理化特性对于浮游细菌群落组成具有较大的影响[44-45],冗余分析结果显示TDS和Sal是显著影响纳木错浮游细菌群落分布的环境因子(P<0.01),这与Liu等[19]在2010年研究的结果不同.研究表明,TDS通过影响水体的透明度,来影响水体中以光能作为能源的硝化和反硝化类细菌的繁殖.当TDS升高时,浊度随之升高,水体透明度降低,导致水体中浮游细菌能够接受到的光照强度减弱,从而导致水体中硝化和反硝化细菌生物量减少;反之,当TDS降低时,水体中光照充足,从而促进了水体中浮游细菌群落的繁殖[44].在本研究中发现,多类浮游细菌群落与TDS浓度呈明显的正相关关系,造成这种现象的原因可能与纳木错处于青藏高原这一地理环境有关,这与处于低海拔的湖泊有差异.纳木错水的一部分来源于冰川融水,水体本身TDS值较小,再加上外界的干扰很小,浑浊度小,湖水清澈.推测可能是当水体TDS值较低时,小范围的升高并不会影响浮游细菌的繁殖效率;相反,当TDS本身处于临界值左右时,在一定范围内的增加可能会对细菌的增长产生影响. ...
... [44].在本研究中发现,多类浮游细菌群落与TDS浓度呈明显的正相关关系,造成这种现象的原因可能与纳木错处于青藏高原这一地理环境有关,这与处于低海拔的湖泊有差异.纳木错水的一部分来源于冰川融水,水体本身TDS值较小,再加上外界的干扰很小,浑浊度小,湖水清澈.推测可能是当水体TDS值较低时,小范围的升高并不会影响浮游细菌的繁殖效率;相反,当TDS本身处于临界值左右时,在一定范围内的增加可能会对细菌的增长产生影响. ...
珠江河口浮游细菌群落结构及影响因素
2
2019
... 水体理化特性对于浮游细菌群落组成具有较大的影响[44-45],冗余分析结果显示TDS和Sal是显著影响纳木错浮游细菌群落分布的环境因子(P<0.01),这与Liu等[19]在2010年研究的结果不同.研究表明,TDS通过影响水体的透明度,来影响水体中以光能作为能源的硝化和反硝化类细菌的繁殖.当TDS升高时,浊度随之升高,水体透明度降低,导致水体中浮游细菌能够接受到的光照强度减弱,从而导致水体中硝化和反硝化细菌生物量减少;反之,当TDS降低时,水体中光照充足,从而促进了水体中浮游细菌群落的繁殖[44].在本研究中发现,多类浮游细菌群落与TDS浓度呈明显的正相关关系,造成这种现象的原因可能与纳木错处于青藏高原这一地理环境有关,这与处于低海拔的湖泊有差异.纳木错水的一部分来源于冰川融水,水体本身TDS值较小,再加上外界的干扰很小,浑浊度小,湖水清澈.推测可能是当水体TDS值较低时,小范围的升高并不会影响浮游细菌的繁殖效率;相反,当TDS本身处于临界值左右时,在一定范围内的增加可能会对细菌的增长产生影响. ...
... [44].在本研究中发现,多类浮游细菌群落与TDS浓度呈明显的正相关关系,造成这种现象的原因可能与纳木错处于青藏高原这一地理环境有关,这与处于低海拔的湖泊有差异.纳木错水的一部分来源于冰川融水,水体本身TDS值较小,再加上外界的干扰很小,浑浊度小,湖水清澈.推测可能是当水体TDS值较低时,小范围的升高并不会影响浮游细菌的繁殖效率;相反,当TDS本身处于临界值左右时,在一定范围内的增加可能会对细菌的增长产生影响. ...
Influences of salinity on the bacterial community composition in overlying water of Yuniao River
2
2022
... 水体理化特性对于浮游细菌群落组成具有较大的影响[44-45],冗余分析结果显示TDS和Sal是显著影响纳木错浮游细菌群落分布的环境因子(P<0.01),这与Liu等[19]在2010年研究的结果不同.研究表明,TDS通过影响水体的透明度,来影响水体中以光能作为能源的硝化和反硝化类细菌的繁殖.当TDS升高时,浊度随之升高,水体透明度降低,导致水体中浮游细菌能够接受到的光照强度减弱,从而导致水体中硝化和反硝化细菌生物量减少;反之,当TDS降低时,水体中光照充足,从而促进了水体中浮游细菌群落的繁殖[44].在本研究中发现,多类浮游细菌群落与TDS浓度呈明显的正相关关系,造成这种现象的原因可能与纳木错处于青藏高原这一地理环境有关,这与处于低海拔的湖泊有差异.纳木错水的一部分来源于冰川融水,水体本身TDS值较小,再加上外界的干扰很小,浑浊度小,湖水清澈.推测可能是当水体TDS值较低时,小范围的升高并不会影响浮游细菌的繁殖效率;相反,当TDS本身处于临界值左右时,在一定范围内的增加可能会对细菌的增长产生影响. ...
... 盐度对纳木错浮游细菌群落分布起着重要作用,是影响其分布格局的主要环境因子[45].随着盐度的梯度变化,纳木错表层水体浮游细菌的丰度在不同样点展现出明显的变化梯度.在不同样点,浮游细菌丰度与盐度水平呈现不同的相关性.李佳岭等[46]研究珠江河口浮游细菌生态过程进行研究后发现,盐度和营养盐是影响水体浮游细菌群落分布格局的两个主要因素.通过研究盐度对浮游细菌群落分布的影响,发现盐度对Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群的丰度有一定的影响,且厌氧氨氧化细菌类群在盐度较高的湖泊数量较多.而对纳木错中浮游细菌类群鉴定后发现,在纳木错中发现了Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群,预测纳木错的高盐环境是它们得以生存的原因之一. ...
盐度对鱼鸟河上覆水细菌群落结构的影响
2
2022
... 水体理化特性对于浮游细菌群落组成具有较大的影响[44-45],冗余分析结果显示TDS和Sal是显著影响纳木错浮游细菌群落分布的环境因子(P<0.01),这与Liu等[19]在2010年研究的结果不同.研究表明,TDS通过影响水体的透明度,来影响水体中以光能作为能源的硝化和反硝化类细菌的繁殖.当TDS升高时,浊度随之升高,水体透明度降低,导致水体中浮游细菌能够接受到的光照强度减弱,从而导致水体中硝化和反硝化细菌生物量减少;反之,当TDS降低时,水体中光照充足,从而促进了水体中浮游细菌群落的繁殖[44].在本研究中发现,多类浮游细菌群落与TDS浓度呈明显的正相关关系,造成这种现象的原因可能与纳木错处于青藏高原这一地理环境有关,这与处于低海拔的湖泊有差异.纳木错水的一部分来源于冰川融水,水体本身TDS值较小,再加上外界的干扰很小,浑浊度小,湖水清澈.推测可能是当水体TDS值较低时,小范围的升高并不会影响浮游细菌的繁殖效率;相反,当TDS本身处于临界值左右时,在一定范围内的增加可能会对细菌的增长产生影响. ...
... 盐度对纳木错浮游细菌群落分布起着重要作用,是影响其分布格局的主要环境因子[45].随着盐度的梯度变化,纳木错表层水体浮游细菌的丰度在不同样点展现出明显的变化梯度.在不同样点,浮游细菌丰度与盐度水平呈现不同的相关性.李佳岭等[46]研究珠江河口浮游细菌生态过程进行研究后发现,盐度和营养盐是影响水体浮游细菌群落分布格局的两个主要因素.通过研究盐度对浮游细菌群落分布的影响,发现盐度对Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群的丰度有一定的影响,且厌氧氨氧化细菌类群在盐度较高的湖泊数量较多.而对纳木错中浮游细菌类群鉴定后发现,在纳木错中发现了Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群,预测纳木错的高盐环境是它们得以生存的原因之一. ...
Advances in ecological research of Pearl River Estuarine bacterioplankton
1
2018
... 盐度对纳木错浮游细菌群落分布起着重要作用,是影响其分布格局的主要环境因子[45].随着盐度的梯度变化,纳木错表层水体浮游细菌的丰度在不同样点展现出明显的变化梯度.在不同样点,浮游细菌丰度与盐度水平呈现不同的相关性.李佳岭等[46]研究珠江河口浮游细菌生态过程进行研究后发现,盐度和营养盐是影响水体浮游细菌群落分布格局的两个主要因素.通过研究盐度对浮游细菌群落分布的影响,发现盐度对Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群的丰度有一定的影响,且厌氧氨氧化细菌类群在盐度较高的湖泊数量较多.而对纳木错中浮游细菌类群鉴定后发现,在纳木错中发现了Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群,预测纳木错的高盐环境是它们得以生存的原因之一. ...
珠江河口的浮游细菌生态学研究进展
1
2018
... 盐度对纳木错浮游细菌群落分布起着重要作用,是影响其分布格局的主要环境因子[45].随着盐度的梯度变化,纳木错表层水体浮游细菌的丰度在不同样点展现出明显的变化梯度.在不同样点,浮游细菌丰度与盐度水平呈现不同的相关性.李佳岭等[46]研究珠江河口浮游细菌生态过程进行研究后发现,盐度和营养盐是影响水体浮游细菌群落分布格局的两个主要因素.通过研究盐度对浮游细菌群落分布的影响,发现盐度对Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群的丰度有一定的影响,且厌氧氨氧化细菌类群在盐度较高的湖泊数量较多.而对纳木错中浮游细菌类群鉴定后发现,在纳木错中发现了Candidatus Brocadia和Candidatus Scalindua等厌氧氨氧化细菌类群,预测纳木错的高盐环境是它们得以生存的原因之一. ...
Network topology reveals high connectance levels and few key microbial genera within soils
1
2014
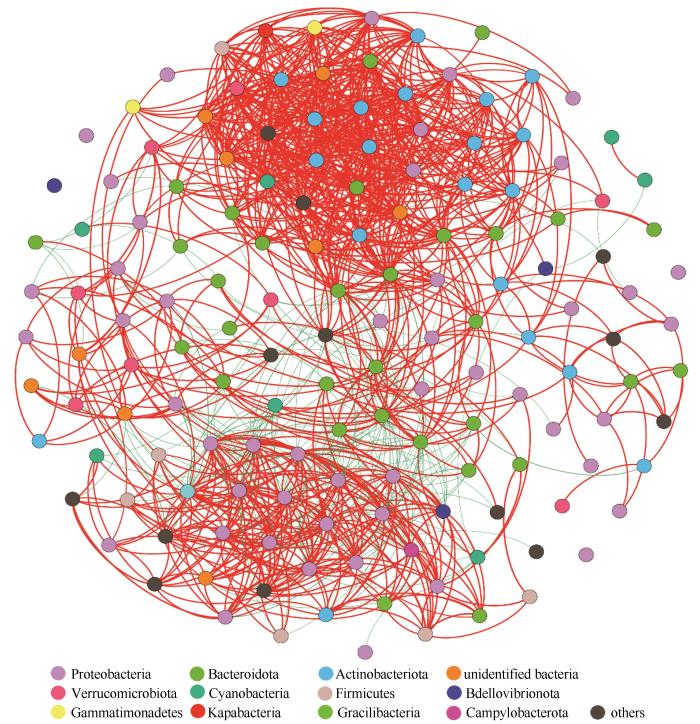
... 在生态系统中,微生物类群之间的相互作用比物种相对丰度和多样性对生态系统循环过程贡献更大.在共现网络中,两个节点间边的正、负相关性分别代表相连物种之间的互惠和竞争关系[47].研究发现,在纳木错水体浮游细菌群落共现网络节点之间正相关所占比例为87.92%,表明门级水平上细菌种群之间的互利共生关系强于它们之间的竞争关系.网络模块化表明,纳木错水体浮游细菌群落网络具有模块化结构;平均路径长度与已报道的显示“小世界”特性的网络平均路径长度在类似范围,说明所构建的网络具有“小世界”属性[48].网络的拓扑结构特征可以反映浮游细菌种群之间的连通性,若网络连通性较高,则说明细菌种群对于环境干扰反应更为迅速和敏感[49].纳木错浮游细菌种群间连通性较强,说明纳木错浮游细菌群落对环境变化反应较为迅速和敏感,对纳木错乃至青藏高原气候变化具有一定指示作用. ...
Biodiversity evolution and adaptation of fungi in extreme environments
1
2013
... 在生态系统中,微生物类群之间的相互作用比物种相对丰度和多样性对生态系统循环过程贡献更大.在共现网络中,两个节点间边的正、负相关性分别代表相连物种之间的互惠和竞争关系[47].研究发现,在纳木错水体浮游细菌群落共现网络节点之间正相关所占比例为87.92%,表明门级水平上细菌种群之间的互利共生关系强于它们之间的竞争关系.网络模块化表明,纳木错水体浮游细菌群落网络具有模块化结构;平均路径长度与已报道的显示“小世界”特性的网络平均路径长度在类似范围,说明所构建的网络具有“小世界”属性[48].网络的拓扑结构特征可以反映浮游细菌种群之间的连通性,若网络连通性较高,则说明细菌种群对于环境干扰反应更为迅速和敏感[49].纳木错浮游细菌种群间连通性较强,说明纳木错浮游细菌群落对环境变化反应较为迅速和敏感,对纳木错乃至青藏高原气候变化具有一定指示作用. ...
Environmental response and ecological function prediction of aquatic bacterial communities in the Weihe River basin
1
2019
... 在生态系统中,微生物类群之间的相互作用比物种相对丰度和多样性对生态系统循环过程贡献更大.在共现网络中,两个节点间边的正、负相关性分别代表相连物种之间的互惠和竞争关系[47].研究发现,在纳木错水体浮游细菌群落共现网络节点之间正相关所占比例为87.92%,表明门级水平上细菌种群之间的互利共生关系强于它们之间的竞争关系.网络模块化表明,纳木错水体浮游细菌群落网络具有模块化结构;平均路径长度与已报道的显示“小世界”特性的网络平均路径长度在类似范围,说明所构建的网络具有“小世界”属性[48].网络的拓扑结构特征可以反映浮游细菌种群之间的连通性,若网络连通性较高,则说明细菌种群对于环境干扰反应更为迅速和敏感[49].纳木错浮游细菌种群间连通性较强,说明纳木错浮游细菌群落对环境变化反应较为迅速和敏感,对纳木错乃至青藏高原气候变化具有一定指示作用. ...
渭河流域水体细菌群落的环境响应及生态功能预测
1
2019
... 在生态系统中,微生物类群之间的相互作用比物种相对丰度和多样性对生态系统循环过程贡献更大.在共现网络中,两个节点间边的正、负相关性分别代表相连物种之间的互惠和竞争关系[47].研究发现,在纳木错水体浮游细菌群落共现网络节点之间正相关所占比例为87.92%,表明门级水平上细菌种群之间的互利共生关系强于它们之间的竞争关系.网络模块化表明,纳木错水体浮游细菌群落网络具有模块化结构;平均路径长度与已报道的显示“小世界”特性的网络平均路径长度在类似范围,说明所构建的网络具有“小世界”属性[48].网络的拓扑结构特征可以反映浮游细菌种群之间的连通性,若网络连通性较高,则说明细菌种群对于环境干扰反应更为迅速和敏感[49].纳木错浮游细菌种群间连通性较强,说明纳木错浮游细菌群落对环境变化反应较为迅速和敏感,对纳木错乃至青藏高原气候变化具有一定指示作用. ...


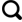





 甘公网安备 62010202000676号
甘公网安备 62010202000676号