Advance in researches of virus in cryoconite on glacier surface
1
2019
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
冰川表面冰尘洞内病毒研究进展
1
2019
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
Changes of the runoff and its components in Urumqi Glacier No.1 catchment, Tianshan Mountains, 1959 - 2017
1
2019
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
1959 - 2017年天山乌鲁木齐河源1号冰川流域径流及其组分变化
1
2019
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
The occurrence and biogeochemistry of microbes in extreme environments
1
2006
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
极端环境下的微生物及其生物地球化学作用
1
2006
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
Modelling glacier variation and its impact on water resource in the Urumqi Glacier No.1 in Central Asia
1
2018
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
Chronicle of a death foretold: Extinction of the small-size tropical glaciers of Popocatépetl volcano (Mexico)
1
2007
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
Psychrophilic yeasts from worldwide glacial habitats: diversity, adaptation strategies and biotechnological potential
1
2012
... 冰川占地球陆地面积的10%~11%, 对维持地球生态系统的平衡、 全球气候的稳定发挥着极其重要的作用[1-2].近几十年来的研究发现, 冰川表面的冰尘、 积雪、 冰芯及冰川底部生境同常温生态系统类似, 也是由细菌、 真菌、 微藻、 原生动物等各种生物介导和促进的生物地球化学过程, 低温环境中的微生物对维持冰川的生态平衡、 碳氮等元素的循环有重要作用[3].随着全球气候变暖趋势的加剧, 地球上绝大多数冰原及冰川处于持续退缩中, 预计到2050年冰川面积将会比1980年减少一半(54%)[4].全球气候变暖在加剧由微生物介导的生物地球化学过程的同时, 也显著影响了冰川的退缩及其前沿生境、 下游融水流域体系的生态学过程, 进而影响到局域的气候变化和生态系统生物多样性[5].而冰川微生物在基因资源的挖掘利用、 低温酶的开发以及生物修复等方面的应用潜力巨大[6].因此, 保护冰川环境中的生物资源刻不容缓. ...
Growth, lipid accumulation,and fatty acid composition in obligate psychrophilic,facultative psychrophilic, and mesophilic yeasts
1
2009
... 酵母菌是发酵工业和生物技术方面与人类关系最为密切的一类真核微生物.目前发现冰川生境中也广泛分布酵母菌[7].研究显示, 冰川来源的酵母菌能够产各种低温酶, 最常见酶包括淀粉酶、 纤维素酶、 果胶酶、 几丁质酶、 蛋白酶和脂肪酶等.这些酶在食品、 生物燃料以及洗涤剂行业中有很大的应用价值, 譬如低温蛋白酶在食品工业中, 可用于加速奶酪成熟、 保持冷藏肉制品的鲜嫩、 防止葡萄酒酿造中由蛋白质产生的浑浊[8].在纺织工业中, 蛋白酶可用于“冷洗”工艺和常温洗涤纺织品的污垢去除.耐低温果胶酶可应用在果汁澄清, 低温条件下防止食品的微生物污染和保护热敏性物质[9].此外, 有研究表明, 部分低温酵母菌可以生产在商业中有重要价值的类胡萝卜素, 如β-胡萝卜素、 圆酵母素(torulene)、 红酵母红素(torularhodin)和虾青素[10], 这些类胡萝卜素可以作为维生素A的前体物质被添加到食品和饲料中. ...
Low-temperature extremophiles and their applications
1
2002
... 酵母菌是发酵工业和生物技术方面与人类关系最为密切的一类真核微生物.目前发现冰川生境中也广泛分布酵母菌[7].研究显示, 冰川来源的酵母菌能够产各种低温酶, 最常见酶包括淀粉酶、 纤维素酶、 果胶酶、 几丁质酶、 蛋白酶和脂肪酶等.这些酶在食品、 生物燃料以及洗涤剂行业中有很大的应用价值, 譬如低温蛋白酶在食品工业中, 可用于加速奶酪成熟、 保持冷藏肉制品的鲜嫩、 防止葡萄酒酿造中由蛋白质产生的浑浊[8].在纺织工业中, 蛋白酶可用于“冷洗”工艺和常温洗涤纺织品的污垢去除.耐低温果胶酶可应用在果汁澄清, 低温条件下防止食品的微生物污染和保护热敏性物质[9].此外, 有研究表明, 部分低温酵母菌可以生产在商业中有重要价值的类胡萝卜素, 如β-胡萝卜素、 圆酵母素(torulene)、 红酵母红素(torularhodin)和虾青素[10], 这些类胡萝卜素可以作为维生素A的前体物质被添加到食品和饲料中. ...
Cold-active pectinolytic activity of psychrophilic-basidiomycetous yeast Cystofilobasidium capitatum strain PPY-1
1
2002
... 酵母菌是发酵工业和生物技术方面与人类关系最为密切的一类真核微生物.目前发现冰川生境中也广泛分布酵母菌[7].研究显示, 冰川来源的酵母菌能够产各种低温酶, 最常见酶包括淀粉酶、 纤维素酶、 果胶酶、 几丁质酶、 蛋白酶和脂肪酶等.这些酶在食品、 生物燃料以及洗涤剂行业中有很大的应用价值, 譬如低温蛋白酶在食品工业中, 可用于加速奶酪成熟、 保持冷藏肉制品的鲜嫩、 防止葡萄酒酿造中由蛋白质产生的浑浊[8].在纺织工业中, 蛋白酶可用于“冷洗”工艺和常温洗涤纺织品的污垢去除.耐低温果胶酶可应用在果汁澄清, 低温条件下防止食品的微生物污染和保护热敏性物质[9].此外, 有研究表明, 部分低温酵母菌可以生产在商业中有重要价值的类胡萝卜素, 如β-胡萝卜素、 圆酵母素(torulene)、 红酵母红素(torularhodin)和虾青素[10], 这些类胡萝卜素可以作为维生素A的前体物质被添加到食品和饲料中. ...
Isolation of carotenoid-producing yeasts from an alpine glacier
1
2014
... 酵母菌是发酵工业和生物技术方面与人类关系最为密切的一类真核微生物.目前发现冰川生境中也广泛分布酵母菌[7].研究显示, 冰川来源的酵母菌能够产各种低温酶, 最常见酶包括淀粉酶、 纤维素酶、 果胶酶、 几丁质酶、 蛋白酶和脂肪酶等.这些酶在食品、 生物燃料以及洗涤剂行业中有很大的应用价值, 譬如低温蛋白酶在食品工业中, 可用于加速奶酪成熟、 保持冷藏肉制品的鲜嫩、 防止葡萄酒酿造中由蛋白质产生的浑浊[8].在纺织工业中, 蛋白酶可用于“冷洗”工艺和常温洗涤纺织品的污垢去除.耐低温果胶酶可应用在果汁澄清, 低温条件下防止食品的微生物污染和保护热敏性物质[9].此外, 有研究表明, 部分低温酵母菌可以生产在商业中有重要价值的类胡萝卜素, 如β-胡萝卜素、 圆酵母素(torulene)、 红酵母红素(torularhodin)和虾青素[10], 这些类胡萝卜素可以作为维生素A的前体物质被添加到食品和饲料中. ...
Diversity and bioprospecting of fungal communities associated with endemic and cold-adapted macroalgae in Antarctica
1
2013
... 前期研究资料显示, 在冰川中分布最广泛、 抗逆性极强、 产类胡萝卜素一类担子菌酵母是红酵母属(Rhodotorula).这些酵母菌在南极、 北极、 高山冰川以及海冰等低温环境被频繁分离[11].传统的Rhodotorula酵母是一个多系起源的分类单元(polyphyletic taxa), 隶属于其中的成员生理生化特性多样复杂, 系统发育甚至横跨了不同的纲(Class)[12].根据最新的基于分子系统学方法的酵母菌分类系统, 原Rhodotorula属的分类进行了修订, 只有一些种被保留, 其他成员被划分到不同的属, 包括Symmetrospora、 Buckleyzyma、 Microsporomyces、 Sakaguchia、 Cystobasidium、 Colacogloea、 Pseudohyphozyma、 Phenoliferia和Rhodosporidiobolus等[13]. ...
The yeasts, a taxonomic study
2
1953
... 前期研究资料显示, 在冰川中分布最广泛、 抗逆性极强、 产类胡萝卜素一类担子菌酵母是红酵母属(Rhodotorula).这些酵母菌在南极、 北极、 高山冰川以及海冰等低温环境被频繁分离[11].传统的Rhodotorula酵母是一个多系起源的分类单元(polyphyletic taxa), 隶属于其中的成员生理生化特性多样复杂, 系统发育甚至横跨了不同的纲(Class)[12].根据最新的基于分子系统学方法的酵母菌分类系统, 原Rhodotorula属的分类进行了修订, 只有一些种被保留, 其他成员被划分到不同的属, 包括Symmetrospora、 Buckleyzyma、 Microsporomyces、 Sakaguchia、 Cystobasidium、 Colacogloea、 Pseudohyphozyma、 Phenoliferia和Rhodosporidiobolus等[13]. ...
... 根据文献报道, 南极、 北极及环北极地区、 中低纬度山岳冰川环境中最常见的可培养酵母菌有Cryptococcus、 Rhodotorula和Mrakia[26]等担子菌纲酵母菌, 而Rhodotorula和Cryptococcus在低温环境中是绝对优势的属[27].其中南极、 北极、 欧洲冰川、 南美洲冰川和深海中最常见的红酵母种包括R.aurantiaca、 Phenoliferia glacialis (以前称Rhodotorula glacialis)、 Cytstobasidium minuta (以前称Rhodotorula minuta)、 R.glutinis、 R.mucilaginosa、 R.diobovata (以前称Rhodosporidium diobovatum)和R.kratochvilovae.在欧洲冰川生境中特有的种有Phenoliferia psychrophenolica (以前称Rhodotorula psychrophenolica)和Phenoliferia psychrophila (以前称Rhodotorula psychrophila), 而在南极地区土壤分布的特有种包括Colacogloea diffluens (以前称Rhodotorula diffluens)、 Sampaiozyma ingeniose (以前称Rhodotorula ingeniose)、 R.auriculariae和Cytstobasidium pallidas(以前称Rhodotorula pallidas).R.araucariae大多分离自腐烂的植物体表[12], 在冰川浅冰芯中很少报道, 从乌源1号冰川冰芯中分离出的该菌种很可能是由风等外力作用将其带到冰川表面, 并被沉降到冰芯中.一般认为, 0 ℃以下水被冻结生命无法利用, 因此冰川中的酵母菌面临着最主要生存压力也是水分的获取.研究发现由于受冰晶周围存在的盐分的影响, 冰晶之间的液态水在-30 ℃的仍可保持液态, 并且不容易受到大气升华或蒸发的影响, 是冰川内部包括酵母菌在内的各种生命可以存活的主要原因[28].因此, 来自冰川冰芯的微生物往往具有一定的耐盐性.本研究显示, 分离红酵母菌的最高耐盐度为8%, 这与北极冰川酵母基本一致[29].此外, 生存于冰川中的微生物为了适应低温环境, 最适生长温度相对较低, 依据对温度的生长敏感性, 可将其分为宽温型和窄温型.已经报道的酵母菌中, Cryptococcus、 Rhodotorula和Mrakia属的一些种被发现是专性嗜冷菌, 属于窄温型.一些报道的冰川红酵母其最适生长温度一般在20 ℃左右[30].本研究分离的所有菌株其最适生长温度在21 ℃或24 ℃左右, 在30 ℃、 甚至37 ℃能够缓慢生长, 应该属于宽温型的兼性耐冷微生物. ...
Phylogenetic classification of yeasts and related taxa within Pucciniomycotina
1
2015
... 前期研究资料显示, 在冰川中分布最广泛、 抗逆性极强、 产类胡萝卜素一类担子菌酵母是红酵母属(Rhodotorula).这些酵母菌在南极、 北极、 高山冰川以及海冰等低温环境被频繁分离[11].传统的Rhodotorula酵母是一个多系起源的分类单元(polyphyletic taxa), 隶属于其中的成员生理生化特性多样复杂, 系统发育甚至横跨了不同的纲(Class)[12].根据最新的基于分子系统学方法的酵母菌分类系统, 原Rhodotorula属的分类进行了修订, 只有一些种被保留, 其他成员被划分到不同的属, 包括Symmetrospora、 Buckleyzyma、 Microsporomyces、 Sakaguchia、 Cystobasidium、 Colacogloea、 Pseudohyphozyma、 Phenoliferia和Rhodosporidiobolus等[13]. ...
Variation of continental glacier and temperate glacier in China: a case study of Glacier No.1 at the headwaters of the Urumqi River and Baishui Glacier No.1
1
2018
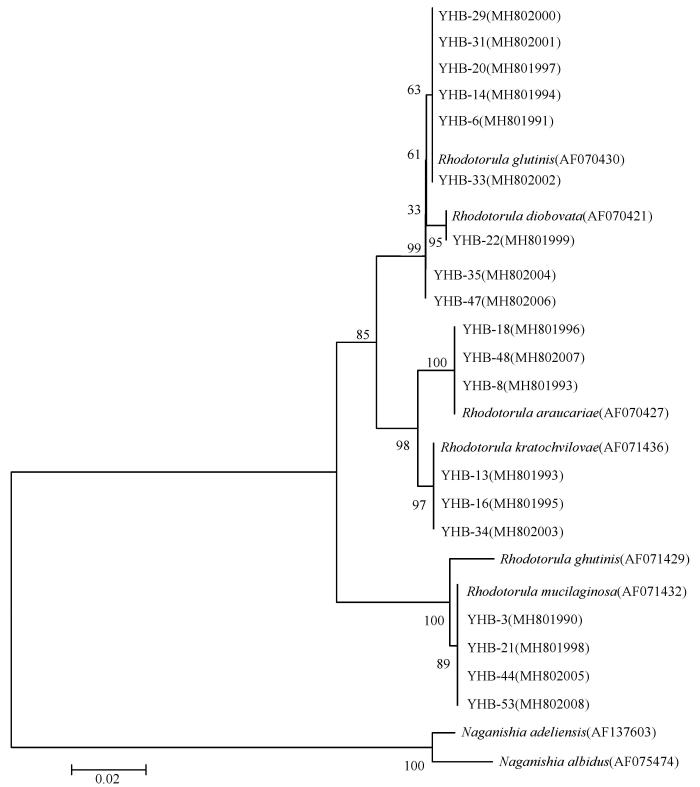
... 乌鲁木齐河源1号冰川(简称乌源1号冰川)位于天山中段天格尔峰北坡, 属于大陆型冰川, 是我国监测时间最长、 研究最为系统的冰川, 也是世界冰川监测服务处(WGMS)设立的全球10个重点观测的参照冰川之一[14].作者团队前期对乌源1号冰川表面积雪、 表面冰尘和底部沉积层等生境中的真菌和酵母菌多样性分别做了报道[15-16], 同时对乌源1号冰川细菌产酶特征进行了研究.考虑到目前为止低温酶生物技术并不成熟, 尤其对我国冰川酵母菌资源和低温酶的研究报道很少, 需要相关研究填补空白.本文从乌源1号冰川浅冰芯中分离到产色素的菌株45株, 隶属于新修订后的红酵母属(Rhodotorula), 重点比较了菌株胞外酶谱的种间和种内差异, 以及生长温度的种属差异性, 以期为高效产低温酶和色素菌株的开发与应用奠定基础. ...
中国大陆型冰川和海洋性冰川变化比较分析——以天山乌鲁木齐河源1号冰川和玉龙雪山白水河1号冰川为例
1
2018
... 乌鲁木齐河源1号冰川(简称乌源1号冰川)位于天山中段天格尔峰北坡, 属于大陆型冰川, 是我国监测时间最长、 研究最为系统的冰川, 也是世界冰川监测服务处(WGMS)设立的全球10个重点观测的参照冰川之一[14].作者团队前期对乌源1号冰川表面积雪、 表面冰尘和底部沉积层等生境中的真菌和酵母菌多样性分别做了报道[15-16], 同时对乌源1号冰川细菌产酶特征进行了研究.考虑到目前为止低温酶生物技术并不成熟, 尤其对我国冰川酵母菌资源和低温酶的研究报道很少, 需要相关研究填补空白.本文从乌源1号冰川浅冰芯中分离到产色素的菌株45株, 隶属于新修订后的红酵母属(Rhodotorula), 重点比较了菌株胞外酶谱的种间和种内差异, 以及生长温度的种属差异性, 以期为高效产低温酶和色素菌株的开发与应用奠定基础. ...
Habitat-specificity and diversity of culturable cold-adapted yeasts of a cold-based glacier in the Tianshan Mountains, northwestern China
1
2019
... 乌鲁木齐河源1号冰川(简称乌源1号冰川)位于天山中段天格尔峰北坡, 属于大陆型冰川, 是我国监测时间最长、 研究最为系统的冰川, 也是世界冰川监测服务处(WGMS)设立的全球10个重点观测的参照冰川之一[14].作者团队前期对乌源1号冰川表面积雪、 表面冰尘和底部沉积层等生境中的真菌和酵母菌多样性分别做了报道[15-16], 同时对乌源1号冰川细菌产酶特征进行了研究.考虑到目前为止低温酶生物技术并不成熟, 尤其对我国冰川酵母菌资源和低温酶的研究报道很少, 需要相关研究填补空白.本文从乌源1号冰川浅冰芯中分离到产色素的菌株45株, 隶属于新修订后的红酵母属(Rhodotorula), 重点比较了菌株胞外酶谱的种间和种内差异, 以及生长温度的种属差异性, 以期为高效产低温酶和色素菌株的开发与应用奠定基础. ...
Composition and phylogeny of fungal community in supraglacial cryoconite and subglacial sediments of the Glacier No.1 at headwaters of the Urumqi River in Tianshan Mountains
1
2017
... 乌鲁木齐河源1号冰川(简称乌源1号冰川)位于天山中段天格尔峰北坡, 属于大陆型冰川, 是我国监测时间最长、 研究最为系统的冰川, 也是世界冰川监测服务处(WGMS)设立的全球10个重点观测的参照冰川之一[14].作者团队前期对乌源1号冰川表面积雪、 表面冰尘和底部沉积层等生境中的真菌和酵母菌多样性分别做了报道[15-16], 同时对乌源1号冰川细菌产酶特征进行了研究.考虑到目前为止低温酶生物技术并不成熟, 尤其对我国冰川酵母菌资源和低温酶的研究报道很少, 需要相关研究填补空白.本文从乌源1号冰川浅冰芯中分离到产色素的菌株45株, 隶属于新修订后的红酵母属(Rhodotorula), 重点比较了菌株胞外酶谱的种间和种内差异, 以及生长温度的种属差异性, 以期为高效产低温酶和色素菌株的开发与应用奠定基础. ...
天山乌源1号冰川表面冰尘及底部沉积层真菌群落结构比较及其系统发育分析
1
2017
... 乌鲁木齐河源1号冰川(简称乌源1号冰川)位于天山中段天格尔峰北坡, 属于大陆型冰川, 是我国监测时间最长、 研究最为系统的冰川, 也是世界冰川监测服务处(WGMS)设立的全球10个重点观测的参照冰川之一[14].作者团队前期对乌源1号冰川表面积雪、 表面冰尘和底部沉积层等生境中的真菌和酵母菌多样性分别做了报道[15-16], 同时对乌源1号冰川细菌产酶特征进行了研究.考虑到目前为止低温酶生物技术并不成熟, 尤其对我国冰川酵母菌资源和低温酶的研究报道很少, 需要相关研究填补空白.本文从乌源1号冰川浅冰芯中分离到产色素的菌株45株, 隶属于新修订后的红酵母属(Rhodotorula), 重点比较了菌株胞外酶谱的种间和种内差异, 以及生长温度的种属差异性, 以期为高效产低温酶和色素菌株的开发与应用奠定基础. ...
The diversity,extracellular enzymatlc activities and photoprotective compounds of yeasts isolated in antarctica
2
2011
... 将用于菌种分离的样品在室温下融化, 用孔径0.45 μm、 直径47 mm的无菌硝化纤维膜过滤冰芯融水[17].将过滤后的膜分别置于四种培养基表面, RDBC培养基、 DG培养基、 MYP培养基、 MYP5培养基[18].培养皿分别置于4 ℃和16 ℃下培养14 d后挑取酵母菌单菌落.挑取的单菌落经划线分离纯化后分别用于菌种保藏和提取DNA. ...
... 在补充有2%可溶性淀粉、 pH 6.0的YM培养基上筛选产淀粉酶菌株[17].阳性结果表现为当平板上充满1 mL碘液时, 在紫色背景下菌落周围显现透明水解圈. ...
Relative incidence of ascomycetous yeasts in arctic coastal environments
1
2011
... 将用于菌种分离的样品在室温下融化, 用孔径0.45 μm、 直径47 mm的无菌硝化纤维膜过滤冰芯融水[17].将过滤后的膜分别置于四种培养基表面, RDBC培养基、 DG培养基、 MYP培养基、 MYP5培养基[18].培养皿分别置于4 ℃和16 ℃下培养14 d后挑取酵母菌单菌落.挑取的单菌落经划线分离纯化后分别用于菌种保藏和提取DNA. ...
Yeast community survey in the Tagus estuary
1
2005
... DNA提取参考Almeida等[19]的方法, 略有改动.在1.5 mL无菌保藏管中加入500 μL 1×TE缓冲液, 于超净工作台中将在培养皿中已划线纯化的单菌落用无菌接种环挑入无菌保藏管中, 并加入200 μL 424~600 μm的玻璃珠.将无菌保藏管置于MiniBeadbeater-16珠磨式组织研磨器上剧烈震荡2 min, 4 ℃下10 000 r·min-1离心10 min.吸取上层含有DNA的上清液转移到1.5 mL的无菌离心管中并保藏于-20 ℃冰箱中. ...
Identification and characterization of yeasts isolated from sedimentary rocks of Union Glacier at the Antarctica
4
2016
... 将获得的序列在NCBI(National Center of Biotechnology Information)-GenBank(http://www.ncbi.nml.nih.gov)的BLASTN搜索获得的其他酵母序列进行比较.在CLUSTALX1.8程序比对序列.使用neighbor-joining method计算进化距离, 在MEGA6.0软件中用p-distances和Kimura-2parameter双参数法构建系统发育树, 并用bootstrap检验进化树分支聚类的置信度, 重复1 000次[20]. ...
... 在补充有2%酪蛋白和1.5%琼脂的培养基(pH 6.6)中筛选产蛋白酶的菌株.在菌落周围有透明圈的为阳性[20]. ...
... 在补充有0.5%尿素的YM培养基中检测脲酶活性, 阳性结果为添加1%的溴百里香酚蓝染色后菌落周围显现蓝色晕圈[20]. ...
... 将所有菌株按2%的接种量接种于MYP[20]培养基中, 15 ℃静置培养48 h后, 用相差显微镜镜检浓度统一校准为1×106 CFU·mL-1的酵母菌悬液接种在特定底物的琼脂平板上, 15 ℃下培养96 h后测量菌落大小及水解圈、 透明圈、 显色圈半径, 半定量评估菌株的胞外酶活性[25].试验数据用Excel2003进行初步处理后, 采用SPSS17.0软件进行统计分析, 采用单因素方差分析(One-way ANOVA)程序进行方差分析[22], 结果以“平均值±标准差表示”, P<0.05表示差异显著. ...
Diversity of yeasts from puddles in the vicinity of Midre Lovénbreen Glacier, Arctic and bioprospecting for enzymes and fatty acids
2
2009
... 在含有蛋白胨10 g·L-1、 氯化钠5 g·L-1、 CaCl2·2H2O 0.1 g·L-1、 吐温80 10 g·L-1、 琼脂20 g·L-1、 pH 6.8的培养基上筛选脂肪酶活性菌株[21].菌落周围有清晰地水解圈代表产脂肪酶. ...
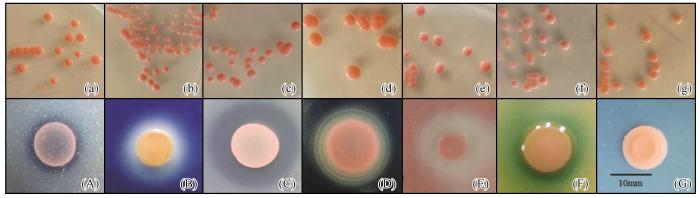
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Extracellular enzymatic activities of basidiomycetous yeasts isolated from glacial and subglacial waters of northwest Patagonia (Argentina)
2
2007
... YNB 6.7 g·L-1、 葡萄糖1 g·L-1、 纤维素5 g·L-1、 琼脂20 g·L-1.用1 mg·mL-1的刚果红溶液淹没平板, 15 min后倒出.然后将板用1 mol·L-1 NaCl浸没15 min.阳性纤维素酶活性定义为红色背景上菌落周围的清晰水解圈[22]. ...
... 将所有菌株按2%的接种量接种于MYP[20]培养基中, 15 ℃静置培养48 h后, 用相差显微镜镜检浓度统一校准为1×106 CFU·mL-1的酵母菌悬液接种在特定底物的琼脂平板上, 15 ℃下培养96 h后测量菌落大小及水解圈、 透明圈、 显色圈半径, 半定量评估菌株的胞外酶活性[25].试验数据用Excel2003进行初步处理后, 采用SPSS17.0软件进行统计分析, 采用单因素方差分析(One-way ANOVA)程序进行方差分析[22], 结果以“平均值±标准差表示”, P<0.05表示差异显著. ...
Pectinolytic yeasts from cold environments: novel findings of Guehomyces pullulans, Cystofilobasidium infirmominiatum and Cryptococcus adeliensis producing pectinases
2
2017
... 在以果胶为底物的培养基上筛选有果胶酶活性的菌株(果胶10 g·L-1; YNB 6.7 g·L-1; 琼脂20 g·-1L; pH 7.0).平板上充满1%十六烷基三甲基溴化铵, 菌落周围产生的清晰地透明圈为阳性结果[23]. ...
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...
Degradation properties of various macromolecules of cultivable psychrophilic bacteria from the deep-sea water of the South Pacific Gyre
1
2016
... 酵母提取物0.2 g·L-1、 (NH4)2SO4 2 g·L-1、 KH2PO4 4 g·L-1、 Na2HPO4 6 g·L-1、 FeSO4·7H2O 0.2 g·L-1、 纯化几丁质25 g·L-1、 CaCl2 1 g·L-1、 硼酸0.01 g·L-1、 硫酸锰0.01 g·L-1、 硫酸锌0.07 g·L-1、 硫酸铜0.05 g·L-1、 三氧化钼0.01 g·L-1, pH 7.0[24].菌落周围有水解圈的为阳性结果. ...
Yeasts from glacial ice of Patagonian Andes, Argentina
3
2012
... 将所有菌株按2%的接种量接种于MYP[20]培养基中, 15 ℃静置培养48 h后, 用相差显微镜镜检浓度统一校准为1×106 CFU·mL-1的酵母菌悬液接种在特定底物的琼脂平板上, 15 ℃下培养96 h后测量菌落大小及水解圈、 透明圈、 显色圈半径, 半定量评估菌株的胞外酶活性[25].试验数据用Excel2003进行初步处理后, 采用SPSS17.0软件进行统计分析, 采用单因素方差分析(One-way ANOVA)程序进行方差分析[22], 结果以“平均值±标准差表示”, P<0.05表示差异显著. ...
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
... [25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Cold-adapted enzymes produced by fungi from terrestrial and marine Antarctic environments
2
2018
... 根据文献报道, 南极、 北极及环北极地区、 中低纬度山岳冰川环境中最常见的可培养酵母菌有Cryptococcus、 Rhodotorula和Mrakia[26]等担子菌纲酵母菌, 而Rhodotorula和Cryptococcus在低温环境中是绝对优势的属[27].其中南极、 北极、 欧洲冰川、 南美洲冰川和深海中最常见的红酵母种包括R.aurantiaca、 Phenoliferia glacialis (以前称Rhodotorula glacialis)、 Cytstobasidium minuta (以前称Rhodotorula minuta)、 R.glutinis、 R.mucilaginosa、 R.diobovata (以前称Rhodosporidium diobovatum)和R.kratochvilovae.在欧洲冰川生境中特有的种有Phenoliferia psychrophenolica (以前称Rhodotorula psychrophenolica)和Phenoliferia psychrophila (以前称Rhodotorula psychrophila), 而在南极地区土壤分布的特有种包括Colacogloea diffluens (以前称Rhodotorula diffluens)、 Sampaiozyma ingeniose (以前称Rhodotorula ingeniose)、 R.auriculariae和Cytstobasidium pallidas(以前称Rhodotorula pallidas).R.araucariae大多分离自腐烂的植物体表[12], 在冰川浅冰芯中很少报道, 从乌源1号冰川冰芯中分离出的该菌种很可能是由风等外力作用将其带到冰川表面, 并被沉降到冰芯中.一般认为, 0 ℃以下水被冻结生命无法利用, 因此冰川中的酵母菌面临着最主要生存压力也是水分的获取.研究发现由于受冰晶周围存在的盐分的影响, 冰晶之间的液态水在-30 ℃的仍可保持液态, 并且不容易受到大气升华或蒸发的影响, 是冰川内部包括酵母菌在内的各种生命可以存活的主要原因[28].因此, 来自冰川冰芯的微生物往往具有一定的耐盐性.本研究显示, 分离红酵母菌的最高耐盐度为8%, 这与北极冰川酵母基本一致[29].此外, 生存于冰川中的微生物为了适应低温环境, 最适生长温度相对较低, 依据对温度的生长敏感性, 可将其分为宽温型和窄温型.已经报道的酵母菌中, Cryptococcus、 Rhodotorula和Mrakia属的一些种被发现是专性嗜冷菌, 属于窄温型.一些报道的冰川红酵母其最适生长温度一般在20 ℃左右[30].本研究分离的所有菌株其最适生长温度在21 ℃或24 ℃左右, 在30 ℃、 甚至37 ℃能够缓慢生长, 应该属于宽温型的兼性耐冷微生物. ...
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Psychrophilic yeasts from worldwide glacial habitats: diversity, adaptation strategies and biotechnological potential
1
2012
... 根据文献报道, 南极、 北极及环北极地区、 中低纬度山岳冰川环境中最常见的可培养酵母菌有Cryptococcus、 Rhodotorula和Mrakia[26]等担子菌纲酵母菌, 而Rhodotorula和Cryptococcus在低温环境中是绝对优势的属[27].其中南极、 北极、 欧洲冰川、 南美洲冰川和深海中最常见的红酵母种包括R.aurantiaca、 Phenoliferia glacialis (以前称Rhodotorula glacialis)、 Cytstobasidium minuta (以前称Rhodotorula minuta)、 R.glutinis、 R.mucilaginosa、 R.diobovata (以前称Rhodosporidium diobovatum)和R.kratochvilovae.在欧洲冰川生境中特有的种有Phenoliferia psychrophenolica (以前称Rhodotorula psychrophenolica)和Phenoliferia psychrophila (以前称Rhodotorula psychrophila), 而在南极地区土壤分布的特有种包括Colacogloea diffluens (以前称Rhodotorula diffluens)、 Sampaiozyma ingeniose (以前称Rhodotorula ingeniose)、 R.auriculariae和Cytstobasidium pallidas(以前称Rhodotorula pallidas).R.araucariae大多分离自腐烂的植物体表[12], 在冰川浅冰芯中很少报道, 从乌源1号冰川冰芯中分离出的该菌种很可能是由风等外力作用将其带到冰川表面, 并被沉降到冰芯中.一般认为, 0 ℃以下水被冻结生命无法利用, 因此冰川中的酵母菌面临着最主要生存压力也是水分的获取.研究发现由于受冰晶周围存在的盐分的影响, 冰晶之间的液态水在-30 ℃的仍可保持液态, 并且不容易受到大气升华或蒸发的影响, 是冰川内部包括酵母菌在内的各种生命可以存活的主要原因[28].因此, 来自冰川冰芯的微生物往往具有一定的耐盐性.本研究显示, 分离红酵母菌的最高耐盐度为8%, 这与北极冰川酵母基本一致[29].此外, 生存于冰川中的微生物为了适应低温环境, 最适生长温度相对较低, 依据对温度的生长敏感性, 可将其分为宽温型和窄温型.已经报道的酵母菌中, Cryptococcus、 Rhodotorula和Mrakia属的一些种被发现是专性嗜冷菌, 属于窄温型.一些报道的冰川红酵母其最适生长温度一般在20 ℃左右[30].本研究分离的所有菌株其最适生长温度在21 ℃或24 ℃左右, 在30 ℃、 甚至37 ℃能够缓慢生长, 应该属于宽温型的兼性耐冷微生物. ...
Psychrophilic enzymes: hot topics in cold adaptation
1
2003
... 根据文献报道, 南极、 北极及环北极地区、 中低纬度山岳冰川环境中最常见的可培养酵母菌有Cryptococcus、 Rhodotorula和Mrakia[26]等担子菌纲酵母菌, 而Rhodotorula和Cryptococcus在低温环境中是绝对优势的属[27].其中南极、 北极、 欧洲冰川、 南美洲冰川和深海中最常见的红酵母种包括R.aurantiaca、 Phenoliferia glacialis (以前称Rhodotorula glacialis)、 Cytstobasidium minuta (以前称Rhodotorula minuta)、 R.glutinis、 R.mucilaginosa、 R.diobovata (以前称Rhodosporidium diobovatum)和R.kratochvilovae.在欧洲冰川生境中特有的种有Phenoliferia psychrophenolica (以前称Rhodotorula psychrophenolica)和Phenoliferia psychrophila (以前称Rhodotorula psychrophila), 而在南极地区土壤分布的特有种包括Colacogloea diffluens (以前称Rhodotorula diffluens)、 Sampaiozyma ingeniose (以前称Rhodotorula ingeniose)、 R.auriculariae和Cytstobasidium pallidas(以前称Rhodotorula pallidas).R.araucariae大多分离自腐烂的植物体表[12], 在冰川浅冰芯中很少报道, 从乌源1号冰川冰芯中分离出的该菌种很可能是由风等外力作用将其带到冰川表面, 并被沉降到冰芯中.一般认为, 0 ℃以下水被冻结生命无法利用, 因此冰川中的酵母菌面临着最主要生存压力也是水分的获取.研究发现由于受冰晶周围存在的盐分的影响, 冰晶之间的液态水在-30 ℃的仍可保持液态, 并且不容易受到大气升华或蒸发的影响, 是冰川内部包括酵母菌在内的各种生命可以存活的主要原因[28].因此, 来自冰川冰芯的微生物往往具有一定的耐盐性.本研究显示, 分离红酵母菌的最高耐盐度为8%, 这与北极冰川酵母基本一致[29].此外, 生存于冰川中的微生物为了适应低温环境, 最适生长温度相对较低, 依据对温度的生长敏感性, 可将其分为宽温型和窄温型.已经报道的酵母菌中, Cryptococcus、 Rhodotorula和Mrakia属的一些种被发现是专性嗜冷菌, 属于窄温型.一些报道的冰川红酵母其最适生长温度一般在20 ℃左右[30].本研究分离的所有菌株其最适生长温度在21 ℃或24 ℃左右, 在30 ℃、 甚至37 ℃能够缓慢生长, 应该属于宽温型的兼性耐冷微生物. ...
Yeasts in high Arctic glaciers: the discovery of a new habitat for eukaryotic microorganisms
1
2007
... 根据文献报道, 南极、 北极及环北极地区、 中低纬度山岳冰川环境中最常见的可培养酵母菌有Cryptococcus、 Rhodotorula和Mrakia[26]等担子菌纲酵母菌, 而Rhodotorula和Cryptococcus在低温环境中是绝对优势的属[27].其中南极、 北极、 欧洲冰川、 南美洲冰川和深海中最常见的红酵母种包括R.aurantiaca、 Phenoliferia glacialis (以前称Rhodotorula glacialis)、 Cytstobasidium minuta (以前称Rhodotorula minuta)、 R.glutinis、 R.mucilaginosa、 R.diobovata (以前称Rhodosporidium diobovatum)和R.kratochvilovae.在欧洲冰川生境中特有的种有Phenoliferia psychrophenolica (以前称Rhodotorula psychrophenolica)和Phenoliferia psychrophila (以前称Rhodotorula psychrophila), 而在南极地区土壤分布的特有种包括Colacogloea diffluens (以前称Rhodotorula diffluens)、 Sampaiozyma ingeniose (以前称Rhodotorula ingeniose)、 R.auriculariae和Cytstobasidium pallidas(以前称Rhodotorula pallidas).R.araucariae大多分离自腐烂的植物体表[12], 在冰川浅冰芯中很少报道, 从乌源1号冰川冰芯中分离出的该菌种很可能是由风等外力作用将其带到冰川表面, 并被沉降到冰芯中.一般认为, 0 ℃以下水被冻结生命无法利用, 因此冰川中的酵母菌面临着最主要生存压力也是水分的获取.研究发现由于受冰晶周围存在的盐分的影响, 冰晶之间的液态水在-30 ℃的仍可保持液态, 并且不容易受到大气升华或蒸发的影响, 是冰川内部包括酵母菌在内的各种生命可以存活的主要原因[28].因此, 来自冰川冰芯的微生物往往具有一定的耐盐性.本研究显示, 分离红酵母菌的最高耐盐度为8%, 这与北极冰川酵母基本一致[29].此外, 生存于冰川中的微生物为了适应低温环境, 最适生长温度相对较低, 依据对温度的生长敏感性, 可将其分为宽温型和窄温型.已经报道的酵母菌中, Cryptococcus、 Rhodotorula和Mrakia属的一些种被发现是专性嗜冷菌, 属于窄温型.一些报道的冰川红酵母其最适生长温度一般在20 ℃左右[30].本研究分离的所有菌株其最适生长温度在21 ℃或24 ℃左右, 在30 ℃、 甚至37 ℃能够缓慢生长, 应该属于宽温型的兼性耐冷微生物. ...
Rhodotorula psychrophila sp. nov., Rhodotorula psychrophenolica sp. nov. and Rhodotorula glacialis sp. nov., novel psychrophilic basidiomycetous yeast species isolated from alpine environments
1
2007
... 根据文献报道, 南极、 北极及环北极地区、 中低纬度山岳冰川环境中最常见的可培养酵母菌有Cryptococcus、 Rhodotorula和Mrakia[26]等担子菌纲酵母菌, 而Rhodotorula和Cryptococcus在低温环境中是绝对优势的属[27].其中南极、 北极、 欧洲冰川、 南美洲冰川和深海中最常见的红酵母种包括R.aurantiaca、 Phenoliferia glacialis (以前称Rhodotorula glacialis)、 Cytstobasidium minuta (以前称Rhodotorula minuta)、 R.glutinis、 R.mucilaginosa、 R.diobovata (以前称Rhodosporidium diobovatum)和R.kratochvilovae.在欧洲冰川生境中特有的种有Phenoliferia psychrophenolica (以前称Rhodotorula psychrophenolica)和Phenoliferia psychrophila (以前称Rhodotorula psychrophila), 而在南极地区土壤分布的特有种包括Colacogloea diffluens (以前称Rhodotorula diffluens)、 Sampaiozyma ingeniose (以前称Rhodotorula ingeniose)、 R.auriculariae和Cytstobasidium pallidas(以前称Rhodotorula pallidas).R.araucariae大多分离自腐烂的植物体表[12], 在冰川浅冰芯中很少报道, 从乌源1号冰川冰芯中分离出的该菌种很可能是由风等外力作用将其带到冰川表面, 并被沉降到冰芯中.一般认为, 0 ℃以下水被冻结生命无法利用, 因此冰川中的酵母菌面临着最主要生存压力也是水分的获取.研究发现由于受冰晶周围存在的盐分的影响, 冰晶之间的液态水在-30 ℃的仍可保持液态, 并且不容易受到大气升华或蒸发的影响, 是冰川内部包括酵母菌在内的各种生命可以存活的主要原因[28].因此, 来自冰川冰芯的微生物往往具有一定的耐盐性.本研究显示, 分离红酵母菌的最高耐盐度为8%, 这与北极冰川酵母基本一致[29].此外, 生存于冰川中的微生物为了适应低温环境, 最适生长温度相对较低, 依据对温度的生长敏感性, 可将其分为宽温型和窄温型.已经报道的酵母菌中, Cryptococcus、 Rhodotorula和Mrakia属的一些种被发现是专性嗜冷菌, 属于窄温型.一些报道的冰川红酵母其最适生长温度一般在20 ℃左右[30].本研究分离的所有菌株其最适生长温度在21 ℃或24 ℃左右, 在30 ℃、 甚至37 ℃能够缓慢生长, 应该属于宽温型的兼性耐冷微生物. ...
Hydrocarbon degradation and enzyme activities of cold-adapted bacteria and yeasts
1
2003
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Cold-loving microbes, plants, and animals: fundamental and applied aspects
1
2007
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Psychrophilic yeasts in glacial environments of Alpine glaciers
3
2008
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
... [33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
... [33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Phylogenetic and physiological diversity of cold-adapted bacteria producing protease from sediments of the bottom layer of the Glacier No.1 in the Tianshan Mountains
1
2013
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
天山一号冰川底部沉积层产蛋白酶耐低温菌株的筛选及其系统发育
1
2013
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Screening and characterization of amylase and cellulase activities in psychrotolerant yeasts
1
2016
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Biodiversity of cold-adapted yeasts from glacial meltwater rivers in Patagonia, Argentina
1
2007
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Diversity and extracellular enzymatic activities of yeasts isolated from King George Island, the sub-Antarctic region
2
2012
... 报道显示, 低温条件下的酵母菌相比细菌具有更强的降解惰性有机大分子(纤维素、 木质素等)的能力[31], 很可能是因为酵母菌具有更独特的产酶谱, 使它们可以利用细菌难以降解的碳源在特殊环境中生存.由于这个原因, 酵母菌在冰川生境的碳素营养循环中发挥重要的作用[32].本研究中的大多数菌株能在低温下产生一种或几种胞外酶, 其中产纤维素酶和果胶酶的菌株最多.文献报道显示, 纤维素酶是高山冰川酵母菌中最常见的胞外酶之一(仅次于脂肪酶), 譬如巴塔哥尼亚安第斯山脉有63%的冰川酵母菌可以产生纤维素酶[25-33].此外, 低温酵母菌分泌果胶酶的频率也很高, 阿尔卑斯冰川中的19株红酵母菌有60%可以产生果胶酶[33].本研究分离的45株菌, 均可以产生果胶酶, 除一株外均产纤维素酶.相对而言, 冰川环境中能够产几丁质酶的温酵母菌报道很少[33].本研究分离的45株同样没发现产胞外几丁质酶的菌株, 很可能与冰川环境中几丁质本身缺乏有关, 而在同样低温的海洋低温酵母中, 产几丁质酶菌株的分离频率极高.这种现象支持一个观点, 生境过滤是微生物地理分布更强的决定因子[34-35].此外, 文献报道南极、 亚南极和高山冰川中分离出的酵母菌中只有少部分菌株具有淀粉酶活性, 主要集中在Mrakia和Rhodotorula这两个属[36].脂肪酶是低温酵母菌产生的最常见的一种酶[25], 已经在Cryptococcus、 Dioszegia、 Leuconeurospora、 Rhodotorula和Wickerhamomyces等属菌株广泛报道[37].有研究发现来自北极Midre Lovénbreen冰川附近水坑中的红酵母菌都不能产生脂肪酶[21], 这与本文研究结果相似, 本文中产脂肪酶红酵母菌株只占9%, 因此我们推测产脂肪酶酵母菌的地理分布可能会受到生长环境的影响.Duarte等[26]研究表明, 有14%的南极酵母能够在固体或者液体介质中生产蛋白酶, 对蛋白酶描述最多的几个种属分别为Cryptococcus、 Mrakia、 Leucosporidium、 Pichia和Rhodotorula[37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
... [37].本实验有20%的菌株可以产生蛋白酶, 但活性稍低. ...
Combinatorial biosynthesis of novel multi-hydroxy carotenoids in the red yeast Xanthophyllomyces dendrorhous
1
2017
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...
Occurrence of photoprotective compounds in yeasts from freshwater ecosystems of Northwestern Patagonia (Argentina)
1
2010
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...
Production of pigments and photo-protective compounds by cold-adapted yeasts
1
2014
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...
Red yeasts and carotenoid production: outlining a future for non-conventional yeasts of biotechnological interest
1
2015
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...
Carotenoids of an Antarctic psychrotolerant bacterium, Sphingobacterium antarcticus, and a mesophilic bacterium, Sphingobacterium multivorum
1
2000
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...
Carotenoid accumulation in the psychrotrophic bacterium Arthrobacter agilis in response to thermal and salt stress
1
2001
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...
1
2014
... 一般认为, 温度是冷环境中的微生物群落分布的最关键因子, 但是高山冰川生境中紫外线辐射也是最关键因子之一.只有具有光保护机制的微生物才能在高紫外线辐射的环境中定植, 譬如类胡萝卜素是微生物中最常见的光保护剂.迄今为止, 已经在多个酵母属中检测到类胡萝卜素, 譬如Cryptococcus、 Cystofilobasidium、 Dioszegia、 Phaffia、 Sporidiobolus、 Sporobolomyces、 Taphrina和Rhodotorula等[23-38].报道发现, 巴塔哥尼亚淡水体系中有50%左右的酵母菌含有类胡萝卜素[39], 而在酵母菌中最常见的几种类胡萝卜素主要有圆酵母素, β-胡萝卜素和γ-胡萝卜素[40].酵母菌产生类胡萝卜素的比例和类型主要取决于它们系统发育地位和培养基, 如类胡罗素之一的圆酵母素通常由R.minuta菌株产生, R.mucilaginosa和R.glutinis菌株主要产生另外一类胡罗素——红酵母红素, 而R.babjevae即产圆酵母素和又能产红酵母红素; 此外, R.sphaerocarpum, R.graminis主要产生β-胡萝卜素[41].据文献报道, 结合在微生物细胞膜上的色素还具有调节细胞膜的流动性的特点[42-43], 可使微生物更好地适应低温环境.因此, 对低温红酵母产类胡萝卜素的性能及其遗传背景差异进行深入研究具有重要意义, 本文将对分离菌株进一步研究, 并另撰文报道.此外, 耐低温酵母菌不仅能产生胞外酶和类胡萝卜素, 还可以产生具有工业应用价值的胞外多糖, 被广泛用于食品、 化妆品、 制药等工业中, 其应用前景非常广阔.近年来, 由于β-葡聚糖具有抗肿瘤、 抗氧化等特性而被广泛研究, 研究表明Candida、 Cryptococcus、 Lipomyces、 Pichia、 Rhodotorula和Sporobolomyces可以合成甘露聚糖、 葡聚糖、 葡甘露聚糖、 半乳甘露聚糖、 磷酸甘露聚糖和葡糖醛酸甘露聚糖[44].微生物产生的胞外多糖的结构、 数量和性质主要取决于菌株的遗传特性、 培养基组成和生长条件, 实现胞多糖的大规模生产具有重要的工业意义. ...


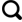




 甘公网安备 62010202000676号
甘公网安备 62010202000676号