0 引言
地球表面近80%的生境被永久或定期暴露于低于5 ℃的寒冷生境中[1],包括深海、极地、冰盖、寒冷沙漠和高山冰川。其中冰川覆盖了地球陆地表面约10%[2],分布极为广泛,因其长期低温、寡营养、冻融循环、强辐射、低水活度等环境特点形成了独有的生境特征并成为制约其中微生物生存的重要限制因素[3]。全球范围下包括极地和非极地的山岳冰川在内的寒冷生境是低温微生物的重要来源,最适生长温度小于等于15 ℃、最高生长温度小于20 ℃,能够在0 ℃甚至更低温度生长的称为嗜冷微生物(psychrophiles);能够在0 ℃生长,但最适生长温度在20~30 ℃左右,最高生长温度在30~37 ℃的称为耐冷微生物(psychrotolerants)[4]。嗜冷菌和耐冷菌以高山冰川作为定植的栖息地,成为该生境中生物多样性重要组成部分,并在营养循环和有机物质矿化方面发挥着重要的作用[5]。然而,目前对于高山冰川的微生物研究主要在细菌多样性及细菌群落组成影响因素等方面,而对于冰川生态系统中酵母菌的多样性及分布格局报道较少[6]。
天山山脉横亘于亚洲中部,作为中亚地区最大的山脉,是全球水热循环的重要组成部分,深刻影响着亚洲以至全球的气候变化[13]。前期我们对天山乌鲁木齐河源1号冰川(简称乌源1号冰川)生境的真菌群落[14],冰川融水、积雪、冰心、沉积物的酵母菌的多样性及分布特征已做了相关报道[15]。本研究旨在揭示冰川空气源可培养酵母菌的多样性,并比较了乌源1号冰川表面不同海拔的位点之间酵母菌类群的异同,以了解冰川空气源酵母菌与其他生境之间的联系,为阐明冰川表面、底部低温酵母菌种群的原位栖息地及可能的生境扩散理论提供理论参考。同时揭示在冰川局域范围内,小幅度海拔梯度变化对空气酵母菌多样性的影响很小。研究将为了解冰川微生物来源,促进天山冰川微生物资源的开发和利用奠定基础提供数据支撑。
1 材料和方法
1.1 实验材料
1.1.1 样品采集
于2017年7月在乌源1号冰川西支尾部及表面分3个位点进行采样:低海拔位点(LA,43°07′125″ N、86°48′707″ E,海拔3 750 m,气温7.23 ℃)、中海拔位点(MA,43°06′54.09″ N、86°48′40.07″ E,海拔3 857 m,气温6.18 ℃)、高海拔位点(HA,43°06′26.63″ N、86°48′22.99″ E,海拔4 013 m,气温4.67 ℃)。使用JH-6120型综合大气采样器,TSP切割器标定流量:100 L·min-1,气体入口流速:0.3 m·s-1。微孔滤膜采用玻璃纤维素滤膜,直径90 mm,孔径0.22 μm,每张滤膜都累计8小时的采样时间,空气样品采集完成后立即用酒精灼烧灭菌的镊子将滤膜装入已灭菌的无酶采样管,置于-4 ℃的车载冰箱中于6小时内运回实验室,于24小时内取样处理分菌。
1.1.2 培养基
为尽可能全面揭示空气中可培养酵母菌的多样性,本实验运用稀释涂平板法来分离培养酵母菌。此外还使用了4种培养基分离酵母菌,所有培养基成分均采用常规用量的1/5,以此来模拟冰川的寡营养状态。所用抗生素为氯霉素(100 mg·mL-1)。
RDBC培养基:Peptone 5 g·L-1,Glucose 10 g·L-1,KH2PO4 1 g·L-1,MgSO4 7H2O 0.5 g·L-1,Dichloran 0.002 g·L-1,Rose bengal 0.025 g·L-1,Agar15 g·L-1;DG18培养基:Glycerol 220 g·L-1,Peptone 5 g·L-1,Glucose 10 g·L-1,KH2PO4 1 g·L-1,MgSO4.7H2O 0.5 g·L-1,Dichloran 0.002 g·L-1,Agar 16 g·L-1;MYP培养基:Malt extract 7 g·L-1,Glucose 1 g·L-1,Yeast extract 5 g·L-1,Soya peptone 2.5 g·L-1,Agar 15 g·L-1;MYP5培养基:Malt extract 7 g·L-1,Glucose 1 g·L-1,Yeast extract 5 g·L-1,Soya peptone 2.5 g·L-1,Agar 15 g·L-1,Nacl 50 g·L-1。
1.2 酵母菌分离纯化
将采样空气滤膜置入100 mL灭菌生理盐水中,进行均质化。待混合均匀后,吸取定量上述液体于孔径0.45 μm、直径47 mm的无菌硝化纤维膜过滤[10]。待过滤完成后将滤膜分别贴于四种分离培养基表面,RDBC培养基、DG18培养基、MYP培养基、MYP5培养基。将贴有滤膜的培养基置于16 ℃下培养7 d后挑取单菌落,连续转接划线培养3次后,记录菌落大小、颜色、透明度、边缘特征、湿润度、菌落凸起等特征,根据表型差异进行初步分离筛选并纯化,所得纯培养物转接YEPG(Yeast extract 10g·L-1; Peptone 10g·L-1; Glucose 20 g·L-1)斜面培养基4 ℃保藏备用。液体纯培养物离心后,加入新鲜培养液重悬,补充15%的灭菌甘油冷冻保藏在-80 ℃冰箱。
1.3 DNA提取和PCR扩增
1.5 ITS基因间隔序列的扩增及菌株系统发育分析
将扩增后MSP-PCR条带对比去重后,挑取同一基因型中的代表菌株以ITS1f(5’-CTTGGTCATTTAGAGGAAGTAA-3’)和ITS4(5’-TCCT-CCGCTTATTGATATGC-3’)为引物进行PCR扩增。PCR反应体系为25 μL(2×PCR Master Mix 12.5 μL;DNA模板2 μL;3 μmol·L-1的ITS1f:0.5 μL;0.2μmol·L-1的ITS4:0.5 μL;ddH2O 9.5 μL)。扩增程序:预变性94 ℃ 3 min;变性95 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 30 s;40 cycles,终延伸72 ℃ 6 min。将3 μL PCR产物点样于2%浓度的凝胶电泳检测后将剩余的PCR产物作为样品送至生物工程(上海)股份有限公司进行测序。
1.6 酵母菌生长温度测定
利用测序结果和NCBI数据库比对筛选出代表菌株,将其活化后按2%的接种量接入5 mL YEPG液体培养基中,分别置于4、10、18、25、30、37 ℃共6个温度梯度下培养,培养96 h后,使用紫外分光光度计于420 nm测OD值。
2 结果与分析
2.1 空气源酵母菌分离纯化与系统发育分析
利用4种琼脂培养基在3个空气采样位点分离到414株酵母菌,从各培养基分离的酵母菌数量分别为:RB(219株);DG18(43株);MYP(117株);MYP5(35株)。酵母菌的丰富度程度与海拔并无明显线性关系,其中135株来自于低海拔位点(LA),176株来自于中海拔位点(MA),103株来自于高海拔位点(HA)。
本研究分离的所有酵母菌,皆为担子菌门,其中白色与乳白色的菌落分离物被视为无色素酵母菌共有258株,另有156株色素菌株。乌源1号冰川空气中分离纯化后的菌株依据菌落颜色,形态分类,菌落颜色丰富(图1),有纯白色、灰白色、粉白色、奶油色、乳黄色、浅黄色、粉红色、橘色,浅棕色等。酵母菌菌落直径约1.5~3.5 mm,小部分菌落直径小于1 mm,酵母菌的细胞形态通常有球形、近球形、卵圆形、椭圆形、圆柱形、棒形、藕节形、柠檬形等,一般为2~4 μm。
图1
图1
乌源1号冰川空气源部分酵母菌代表菌株菌落图片(A: bca-86, Rhodotorula araucariae; B: bca-321, Naganishiaadeliensis; C: bca-248, Filobasidium stepposum; D: bca-32, Filobasidium floriforme; E: bca-502, Dioszegia hungarica; F: bca-175, Rhodotorula glutinis)
Fig.1
Morphological characteristics of colony of representative strains of some yeast species in the Urumqi Glaciers No.1, Tianshan Mountains (A: bca-86, Rhodotorula araucariae; B: bca-321, Naganishia adeliensis; C: bca-248, Filobasidiumstepposum; D: bca-32, Filobasidium floriforme; E: bca-502, Dioszegia hungarica; F: bca-175, Rhodotorula glutinis)
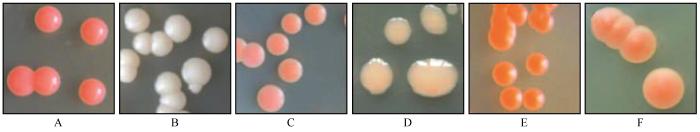
根据菌落形态和生长特性对所有分离得到酵母菌株进行初步分组,并对形态和生长特征相类似的菌株划分为一组。扩增已分离纯化的低温酵母菌菌株的ITS片段并测序,通过使用NCBI(National Center of Biotechnology Information)中的BLAST比对工具在GenBank数据库中进行同源性比对。结果显示,从乌源1号冰川的表面空气中共分离414株酵母菌(表1),MSP-PCR指纹分型划分为53个基因型,从每个基因型中选出2或3株具有代表性的菌株进行ITS-rRNA基因序列分析,共测序139株菌株。测序结果显示分别隶属于9属28种,同时选取28株代表菌株的ITS-rRNA序列构建系统发育树(图2)。
表1 乌源1号冰川空气源酵母菌种的分布及数量
Table 1
| 酵母菌种名 | 原物种名 | 分类学(目) | 代表菌株及 ITS序列登录号 | 序列同源性/% | 不同海拔空气 酵母菌数 | 总分离 酵母菌数 | ||
|---|---|---|---|---|---|---|---|---|
| LA | MA | HA | ||||||
| Agaricomycotina | ||||||||
| Cystofilobasidium infirmominiatum | Cystofilobasidiales | bca-499 (MN128836) | 99 | 1 | 3 | 1 | 5 | |
| Cystofilobasidium macerans | Cryptococcus macerans | Cystofilobasidiales | bca-485 (MN128837) | 100 | 6 | 2 | 2 | 10 |
| Dioszegia butyracea | Tremellales | bca-529 (MN128838) | 100 | 1 | 1 | |||
| Dioszegia crocea | Bullera crocea | Tremellales | bca-109 (MN128839) | 99 | 2 | 2 | 4 | |
| Dioszegia fristingensis | Tremellales | bca-106 (MN128840) | 99 | 3 | 2 | 5 | 10 | |
| Dioszegia hungarica | Cryptococcus hungaricus | Tremellales | bca-502 (MN128841) | 99 | 3 | 12 | 4 | 19 |
| Dioszegia sp. | Tremellales | bca-126 (MN128842) | 99 | 4 | 5 | 3 | 12 | |
| Filobasidium chernovii | Cryptococcus chernovii | Filobasidiales | bca-361 (MN128843) | 100 | 1 | 4 | 1 | 6 |
| Filobasidium elegans | Filobasidiales | bca-52 (MN128844) | 100 | 6 | 5 | 11 | ||
| Filobasidium floriforme | Filobasidiales | bca-32 (MN128845) | 100 | 1 | 1 | 1 | 3 | |
| Filobasidium globisporum | Filobasidiales | bca-290 (MN128846) | 99 | 4 | 3 | 2 | 9 | |
| Filobasidium magnum | Cryptococcus magnus | Filobasidiales | bca-17 (MN128847) | 99 | 7 | 5 | 1 | 13 |
| Filobasidium oeirense | Filobasidiales | bca-395 (MN128848) | 99 | 1 | 1 | |||
| Filobasidium stepposum | Filobasidiales | bca-248 (MN128849) | 100 | 7 | 6 | 5 | 18 | |
| Filobasidium wieringae | Filobasidiales | bca-2 (MN128850) | 99 | 1 | 1 | |||
| Holtermanniella festucosa | Cryptococcus festucosus | Holtermanniales | bca-198 (MN128851) | 100 | 35 | 43 | 14 | 92 |
| Holtermanniella takashimae | Holtermanniales | bca-377 (MN128852) | 99 | 2 | 3 | 5 | ||
| Holtermanniella nyarrowii | Cryptococcus nyarrowii | Holtermanniales | bca-222 (MN128853) | 99 | 11 | 15 | 8 | 34 |
| Holtermanniella wattica | Cryptococcus watticus | Holtermanniales | bca-299 (MN128854) | 99 | 3 | 4 | 7 | |
| Naganishia adeliensis | Cryptococcus adeliensis | Filobasidiales | bca-321( MN128855) | 99 | 11 | 1 | 12 | |
| Naganishia liquefaciens | Cryptococcus liquefaciens | Filobasidiales | bca-84 (MN128856) | 100 | 2 | 2 | ||
| Papiliotrema laurentii | Tremellales | bca-415 (MN128857) | 99 | 2 | 2 | |||
| Vishniacozyma tephrensis | Cryptococcus tephrensis | Tremellales | bca-72 (MN128859) | 99 | 8 | 13 | 5 | 26 |
| Vishniacozyma victoriae | Cryptococcus victoriae | Tremellales | bca-252 (MN128860) | 100 | 20 | 39 | 11 | 70 |
| Pucciniomycotina | ||||||||
| Rhodotorula araucariae | Cystobasidium araucariae | Sporidiobolales | bca-86 (MN128861) | 99 | 14 | 14 | ||
| Rhodotorula glutinis | Cystobasidium glutinis | Sporidiobolales | bca-175 (MN128862) | 99 | 1 | 3 | 4 | |
| Rhodosporidium kratochvilovae | Sporidiobolales | bca-302 (MN128863) | 99 | 4 | 17 | 21 | ||
| Rhodosporidium toruloides | Sporidiobolales | bca-286 (MN128864) | 99 | 1 | 1 | 2 | ||
图2
图2
基于ITS rRNA基因序列的乌源1号冰川空气源酵母菌系统发育树
Fig.2
Neighbour-joining tree showing the phylogenetic relationships among yeast strains, taken from the Urumqi Glacier No.1, based on ITS rRNA gene partial sequences and related sequences downloaded from GenBank (The numbers at the nodes indicating the bootstrap values based on neighbor-joining analyses of 1 000 resampled datasets; bar 0.02 at the bottom is the sequence divergence)
对空气源酵母代表菌株进行ITS序列分析(图2),有伞菌亚门24株,柄锈菌亚门4株。其中bca-2与Filobasidium wieringae;bca-72与Vishniacozyma tephrensis;bca-529与Dioszegia butyrace;bca-502与D.hungarica;同源性高达99%亲缘关系最近。bca-198、bca-222、bca-377、bca-299分属于同一个进化支,与Holtermanniella同源性最高,相似度为100%;bca-286、bca-175、bca-86、bca-302分属于同一个进化支,与Rhodotorula同源性最高,相似度为100%;bca-106、bca-529、bca-109、bca-502聚为一类,与Dioszegia亲缘关系最近;菌株bca-415与Papiliotrema laurentii CBS:5297相似度为100%。分离自HA位点的菌株bca-2与模式菌株CBS11580(GenBank登录号KY103449) Filobasidium wieringae有99%的相似性。分离自MA位点的菌株bca-529与模式菌株CBS10122(KY103348) Dioszegia butyracea有99%的相似性。而来自MA位点的菌株bca-84与模式菌株CBS968(AF444345) Naganishia liquefaciens有97%的相似性。种水平的系统发育分析如图2所示,显示了我们所分离菌株与GenBank库中登记的最接近的CBS酵母菌菌种库的模式菌株的亲缘关系。
2.2 不同海拔空气源酵母菌群落分布特征
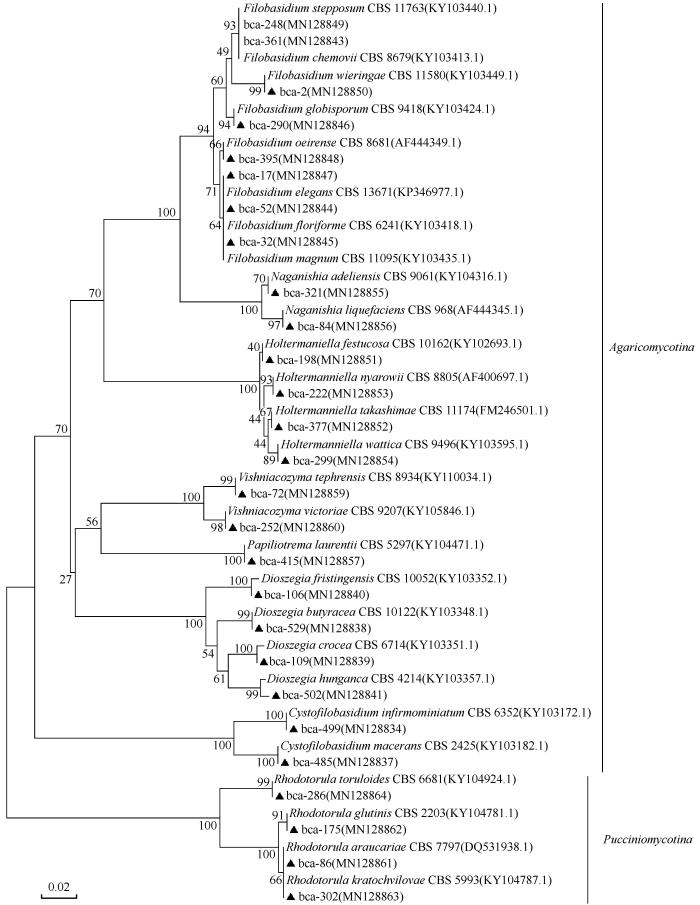
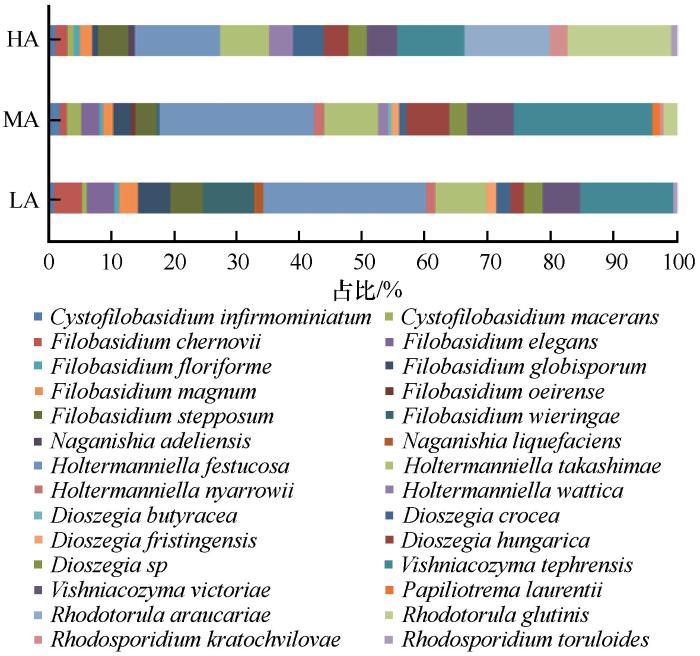
乌源1号冰川表面空气中9个属酵母菌种群结构显示,Filobasidium种类最多分离到8个种,Dioszegia分离到5个种,Holtermanniella分离到4个种,Cystofilobasidium、Naganishia、Vishniacozyma、Rhodotorula、Rhodosporidium均分离到2个种,Papiliotrema种类最少,仅分离到一个种。本研究依据每种酵母菌占总分离酵母菌数量的比例确定其对应的相对丰度。酵母菌属水平结果显示(图3),Holtermanniella相对丰度最高为33.33%,为最优势属,其次为Vishniacozyma(23.19%)和Filobasidium(14.98%)。除了Rhodotorula和Naganishia以外,其他属酵母在3个海拔位点均有分布。随海拔升高,Holtermanniella,Vishniacozyma与Dioszegia相对丰度出现先升高再降低趋势;而Filobasidium,Naganishia与Cystofilobasidium相对丰度呈持续降低趋势;Rhodotorula相对丰度呈持续升高趋势。
图3
图3
不同海拨冰川空气酵母菌属水平的群落组成
Fig.3
Community composition of airborne yeasts at genus level in different altitude of the Urumqi Glacier No.1
酵母菌种水平结果显示(图4),Holtermanniella festucosa的相对丰度最高(22.22%),其次为Vishniacozyma victoriae(16.91%),而Holtermanniella nyarrowii、Vishniacozyma tephrensis和Rhodosporidium kratochvilovae 相对丰度也比较高,均超过了5%。Dioszegia crocea、Rhodosporidium kratochvilovae等菌株丰度均低于1%。综合分析相对丰度与发生率(每个酵母菌种在每个地理位点的出现频率),乌源1号冰川表面空气酵母菌优势种为Holtermanniella festucosa,其占LA样品总菌株数的25.93%,占MA样品总菌数的24.43%,占HA样品总菌数的13.59%。
图4
图4
不同海拨冰川空气酵母菌种水平的群落结构组成
Fig.4
Community composition of airborne yeasts at species level in different altitude of the Urumqi Glacier No.1
2.3 空气源酵母菌最适生长温度
表2 乌源1号冰川空气源酵母菌形态特征及生长特性
Table 2
| 菌株号 | DBBa | 形态学特性 | 生长特性b | |||||
|---|---|---|---|---|---|---|---|---|
| 菌落大小/mm | 菌落颜色 | 菌落质地 | 菌落表面 | 细胞形态 | 温度范围/℃ | |||
| bca-499 | + | 1 | pink | butyrous | glistening smooth | subglobose,ovoid | 4-22-25 | |
| bca-485 | + | 0.5 | bright coral-red | butyrous | smooth | ellipsoid,long-ovoid | 4-16-20 | |
| bca-529 | + | 1.5 | jacinth | butyrous | smooth | ovoid,subglobose,ellipsoidal | 4-18-22 | |
| bca-109 | + | 1 | orang | butyrous | smooth | ovoid,subglobose,ellipsoidal | 4-25-30 | |
| bca-106 | + | 3 | reddish-orange | butyrous | smooth | subglobose, ellipsoidal,elongate,apiculate | 4-18-22 | |
| bca-502 | + | 1 | deep orange | butyrous | delicately wrinkled | subglobose,ovoid,elongate,cylindrical | 4-16-20 | |
| bca-126 | + | 0.5 | deep orange | butyrous | smooth | subglobose,ovoid | 4-22-30 | |
| bca-361 | + | 3 | cream | mucoid | glossy,smooth | subglobose | 4-22-25 | |
| bca-52 | + | 1.5 | grayish-white | mucoid | smooth | ellipsoid,ovoid | 4-25-30 | |
| bca-32 | + | 2 | dull-white,tinge-pink | mucoid | moderately,glossy | subglobose,ovoid,ellipsoid,long-ovoid | 4-25-30 | |
| bca-290 | + | 0.8 | grayish-white cream | mucoid | smooth | globose,ellipsoid | 4-22-25 | |
| bca-17 | + | 0.5 | buff | mucoid | moderately,glossy | globose | 4-25-30 | |
| bca-395 | + | 0.5 | pinkish-cream | mucoid | smooth | subglobose,broadly, ellipsoidal | 4-22-25 | |
| bca-248 | + | 0.5 | light pink | butyrous | glistening,smooth | globose | 4-22-30 | |
| bca-2 | + | 0.5 | pink white | mucoid | smooth | ovoid,spheroidal | 4-25-30 | |
| bca-198 | + | 0.5 | grayish-cream | slimy | glistening,smooth | subglobose,ovoid | 4-18-22 | |
| bca-377 | + | 1 | cream | viscous | moderately,glossy | subglobose,broadly,ellipsoidal | 4-22-25 | |
| bca-222 | + | 0.5 | pale yellow | circular | smooth | spheroidal,ovoid | 4-16-20 | |
| bca-299 | + | 1 | pink white | viscous | moderately,glossy | ovoid | 4-22-30 | |
| bca-321 | + | 1 | white | butyrous | glossy,smooth | subglobose | 4-25-30 | |
| bca-84 | + | 2 | pinkish-cream | mucoid | glossy,smooth | subglobose | 4-22-25 | |
| bca-415 | + | 0.5 | cream | butyrous | moderately,glossy | subglobose,ovoid | 4-22-25 | |
| bca-72 | + | 2 | pale yellowish-brown | mucoid | shiny | ellipsoidal,limoniform,droplet,shaped | 4-22-30 | |
| bca-252 | + | 2 | yellowish-cream | butyrous | shiny | ellipsoidal,fusoidal,subglobose | 4-22-25 | |
| bca-86 | + | 1 | pink | mucoid | smooth glistening | subglobose to ovoid | 4-25-30 | |
| bca-175 | + | 1.5 | coral-red | butyrous | smooth | globose to ovoid,cylindrical to fusiform | 4-22-25 | |
| bca-302 | + | 1.5 | peach to orange | butyrous | semi-shiny | spherical to subglobose,cylindrical | 4-22-25 | |
| bca-286 | + | 0.5 | light pink,deep pink | butyrous | shiny, smoot | subglobose to ovoid | 4-25-30 | |
2.4 酵母菌群落组成及多样性分析
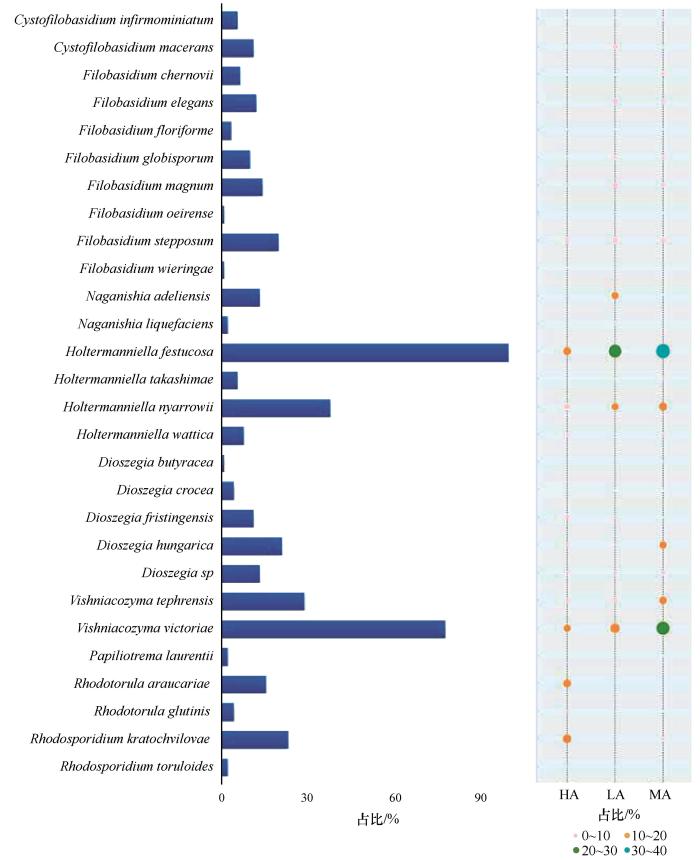
总体而言,乌源1号冰川表面3个不同位点的空气样品中,酵母菌丰度分布存在小幅度的差异。从3个海拔分离出Holtermanniella属酵母菌,占总分离物的33.33%,其次是Vishniacozyma属酵母菌,在分离物总数中占比23.19%。根据最新的分类系统,本研究在不同海拔位点空气分离菌株共有7个属,除Naganishia出现在2个海拔和Papiliotrema只在1个海拔以外,其余各属在3个海拔均有分布(图5)。
图5
图5
乌源1号冰川空气源酵母菌种水平生境组合强度
Fig.5
Horizontal habitat assemblage intensity of glacial airborne yeast species in the the Urumqi Glacier No.1 (HA, LA, and MA representing three sample collection sites, respectively). Note: the bars representing the cumulative relative abundance of each indicator yeast species in all the samples; the size of each circle defining the association strength (indicator value) of a yeast species with the different habitats, such as 0~10: not characteristic; 10~20: weakly characteristic; 20~30: characteristic; 30~40: strongly characteristic
ACE指数Chao指数可反映物种丰富度[19],Chao指数代表物种丰富度,对稀有物种变化敏感。由表3可知,随着海拔小幅度增加,各样点酵母菌群落丰富度指数(ACE指数)与(Chao指数)均显示为MA>HA>LA。在海拔梯度上,ACE指数和Chao指数呈先上升后下降的趋势,在MA位点达到做大值,分别为28.26和27.67,说明空气源酵母菌在MA时物种最为丰富,但统计结果显示差异不显著。在海拔上升的过程中,Chao指数的增加幅度较大,说明稀有菌株出现得更多。Shannon指数代表了样本中物种的均匀度,随海拔梯度上升,各样点酵母菌群落多样性指数(Shannon指数)呈略下降趋势,但差异仍然不显著。
表3 乌源1号冰川不同位点空气酵母菌群落丰富度和多样性指数
Table 3
| 采样位点 | 菌株数 | 物种数 | ACE指数 | Chao指数 | 香浓指数 | 辛普森指数 | 覆盖率 |
|---|---|---|---|---|---|---|---|
| 低海拔位点LA | 135 | 20 | 23.19±5.10 | 22.50±5.51 | 2.57±0.13 | 0.10±0.02 | 0.97 |
| 中海拔位点MA | 176 | 24 | 28.26±4.93 | 27.67±5.23 | 2.65±0.13 | 0.11±0.02 | 0.97 |
| 高海拔位点HA | 103 | 20 | 25.73±8.26 | 24.75±9.43 | 2.65±0.14 | 0.08±0.02 | 0.94 |
3 讨论
3.1 冰川生境酵母菌种群与空气酵母菌种群的关系
将本研究结果与课题组前期对乌源1号冰川中冰尘、表面融水、积雪和冰芯共五种生境的酵母菌组成进行比较研究(表4),冰川五种生境中担子菌酵母均占明显优势,这是多数冰川生态系统的共同特征[23-24]。很多研究报道显示,原属于隐球菌属(Cryptococcus)的酵母菌Vishniacozyma属,其中的Vishniacozyma victoriae与V.tephrensis在5种冰川生境均有分布(表4)。然而,文献报道显示,在地球其他生境这两个种也有分布,譬如植被及果蔬表面。我们的研究发现,乌源1号冰川空气中Vishniacozyma victoriae与V.tephrensis为优势菌,很可能是通过空气传播将植物体表的菌株携带到了冰川生境。但目前对不同生境种群之间的进化关系没有进行深入报道,不同菌株之间ITS基因序列显示了很高的同源性,因此有可能属于世界广布种,也有可能属于同种的不同生态型。从表4可知,乌源1号冰川不同生境广泛分布红酵母属(Rhodotorula)菌株,具有很高的分离频率,表明在低温生境具有很强的适应性[25]。其原因可能是Rhodotorula属酵母菌可产生类胡萝卜素,作为光保护剂能够有效避免紫外线对细胞的损伤。此外,类胡萝卜素是一类膜保护的抗氧化色素,可抵抗UV并增强细胞膜的流动性,能够有效清除自由基[26]。此外,一般认为该属还能够产生胞外多糖,使它们在冰川生境中具有更强的生态胁迫耐受性[27]。实际上,在空气、叶面和腐烂的植物碎片中均能分离到它们,其中Rhodotorula araucariae在腐败的植物体表很容易分离到[28]。因此,以Rhodotorula属酵母菌为模式菌,研究在极端环境条件下,紫外线辐射在对酵母菌菌群结构具有重要的生态学意义。同样,Rhodotorula属在乌源1号冰川空气中也存在,也可能是通过空气传播将植物体表的菌株携带到了冰川生境。但目前对红酵母属的系统发育和分类做了大的修改,也有可能是隶属于不同种的酵母在不同生境的分布需要做深入研究[26]。
表4 乌源1号冰川空气酵母菌与其他4种生境中酵母菌的比较
Table 4
| 酵母菌种名 | TAa | BCb | BW | SN | BB |
|---|---|---|---|---|---|
| Cystofilobasidium infirmominiatum | + | - | + | - | - |
| Cystofilobasidium macerans | + | + | - | + | + |
| Filobasidium chernovii | + | - | + | + | - |
| Filobasidium elegans | + | - | + | - | - |
| Filobasidium floriforme | + | + | - | + | + |
| Filobasidium globisporum | + | - | - | - | - |
| Filobasidium magnum | + | + | + | - | + |
| Filobasidium oeirense | + | - | - | - | + |
| Filobasidium stepposum | + | + | + | + | - |
| Filobasidium wieringae | + | - | - | + | - |
| Naganishia adeliensis | + | + | + | + | + |
| Naganishia liquefaciens | + | + | - | + | + |
| Holtermanniella festucosa | + | - | - | - | - |
| Holtermanniella takashimae | + | - | - | - | - |
| Holtermanniella nyarrowii | + | - | - | - | - |
| Holtermanniella wattica | + | - | - | - | - |
| Dioszegia butyracea | + | + | + | + | + |
| Dioszegia crocea | + | + | + | + | + |
| Dioszegia fristingensis | + | - | + | + | + |
| Dioszegia hungarica | + | + | + | + | - |
| Dioszegia sp | + | + | + | - | + |
| Vishniacozyma tephrensis | + | + | + | + | + |
| Vishniacozyma victoriae | + | + | + | + | + |
| Papiliotrema laurentii | + | - | + | + | + |
| Rhodotorula araucariae | + | + | - | + | + |
| Rhodotorula glutinis | + | + | + | + | + |
| Rhodosporidium kratochvilovae | + | + | + | - | + |
| Rhodosporidium toruloides | + | + | + | + | + |
鉴于以上情况,人们很容易认为冰川生境的酵母菌与空气酵母菌密切相关。但本研究一个例外的发现是空气源的优势酵母属Holtermanniella,它们在冰川中很少被分离到[13],这说明冰川对外源微生物具有选择作用,即Holtermanniella属作为外源种群不适应冰川生境[13]。表4显示,Holtermanniella属中H.festucosa、H.takashimae、H.nyarrowii、H.lawattica在冰川的冰尘,融水,雪水,冰芯中均未被分离到,但在空气中属于优势种群。表明冰川生态系统对外源微生物具有显著的生境过滤作用,只有适应性很强的种群才能进入冰川生态位生殖繁衍,进而通过微进化发生生态生理渐变[29]。因此,我们预期在冰川生境景观尺度下,极端环境因素(包括紫外线、温度、寡营养环境等)对微生物的群落构建(群落结构和物种分布格局)和空间分布格局产生显著的影响[30]。以酵母菌作为范式,研究冰川生境的群落构建过程中,由非生物因素与生物因素的相互作用,及其对微生物群落动态格局贡献度很有必要。
3.2 空气酵母菌群落结构特点
众所周知,冰川区域在空间地理上环境多变,尤其在垂直尺度上环境因子相差较大,形成了不同的小生境,蕴含了丰富的微生物类群。乌源1号冰川表面空气微生物可能来源于内部和外部环境,其中来自周边生境的冰川低温酵母属于原位栖息的本地种(endemic species),由于大气环流随机迁移的属于陆源性外来种(exotic species)。研究发现Naganishia adeliensis在不仅在空气中分离到,在冰川多个生境均有发现,表明该属种类大多为本地菌[13]。Cystofilobasidium infirmominiatum、Filobasidium chernovii、Filobasidium elegans、Filobasidium wieringae主要在空气与冰川表面的积雪生境所分离到,很有可能是从积雪表层传递到空气。第二类是近距离外来菌(Local exotic species),这些菌株很可能主要来自于冰川前沿退缩地的植物花蜜和植物源附生酵母菌。如Rhodotorula属,在空气、叶面和腐烂的植物碎片中均能分离到它们,R.araucariae、R.glutinis、R.kratochvilovae、R.toruloides是空气与冰川表面冰所共有的菌种[27]。第三类是远距离外来菌(Distant exotic species),通过大气环流运动,通过降水(雨、雪),水凝华(云、雾、冰雹)和灰尘沉降等被携带[31-32],这些种类可能来自空间地理差异较大的生态系统,如沙漠[33]、森林[34]等。有报道发现冰川的冰芯中分离出了来自于温带和热带地区的微生物[35]。Holtermanniella属的菌株大多分离自植物体表,在本研究中从冰川生境没有分离到它们,很可能来自温带森林。此外Vishniacozyma victoriae是极地环境的优势种类,也是本研究中的优势菌株,但在非极地环境中普遍分离出该种亲缘关系相近的菌株,表明是全球的广布酵母菌种类[36]。
3.3 不同海拔梯度下冰川表面空气源酵母菌群落构建机制
本研究位点LA选取在冰川前沿高山草甸处,以高山垫状植被为主,此处植物群系开始多元化且动物出没频繁,受动植物及人为干扰因素大。位点MA选取在冰川前沿退缩处,此处均为裸露及风化的岩石,有动物活动。位点HA选取在冰川冰舌中部,此处周围即冰川腹地,下方为冰雪及冰尘洞,受外界因素干扰较小。在冰川表面成功定植的微生物需要耐受大范围幅度剧烈的温度波动,以及抵御太阳辐射,并耐受寡营养等胁迫条件[37-38],在大幅度海拔梯度上呈现出了不同的生态位分布格局[39]。但基于本研究的结果,3个梯度海拔的可培养酵母菌多样性存在差异,很可能是每个位点采集空气样本时,部分环境因素(如风速和颗粒物质量浓度)导致空气采集有一定程度的差异。对于空气源酵母菌来说,由于空气的空间异质性相对较小,在小梯度的海拔梯度下以连续的状态处于动态变化,可培养酵母菌差异并不显著。冰川生境受大气环流及周边人类和动物活动影响,内源、外源酵母菌分辨需要更精确的方法甄别[13],因此,对冰川表面和空气微生物关系需要深入研究。
4 结论
基于乌源1号冰川表面3个海拔高度的空气酵母菌群落结构分析及其与冰川表面生境酵母菌的比较,得到结论如下:
(1)分类特征:乌源1号冰川表面空气分离到的酵母菌全部隶属于担子菌门(Basidiomycota),包括9属28种,伞菌亚门(Agariomycotina)成员占绝对优势。Holtermanniella festucosa与Vishniacozyma victoriae为冰川空气广布的优势酵母菌种。酵母菌大多为来自周边生境的耐冷酵母菌。
(2)分布特征:在小幅度的海拔梯度上,空气酵母菌群落结构有所不同,但多样性指数没有显著差异。基于空气酵母菌和冰川酵母菌种群的比较,冰川生境酵母菌与空气酵母菌密切相关,但冰川生境对外源酵母菌具有明显的生境过滤与选择作用。
参考文献
Extremophilic yeasts: the toughest yeasts around
[J].
Advance in researches of virus in cryoconite on glacier surface
[J].
冰川表面冰尘洞内病毒研究进展
[J].
Psychrophilic lifestyles: mechanisms of adaptation and biotechnological tools
[J].
Fungi from the extremes of life: an untapped treasure for bioactive compounds
[J].
Identification and characterization of yeasts isolated from sedimentary rocks of Union Glacier at the Antarctica
[J].
Cultivable bacteria isolated from the meltwater of the glacier No.1 at headwater of the Urumqi River in Tianshan Mountains physiological-biochemical character and phylogeny
[J].
天山乌鲁木齐河源1号冰川融水可培养细菌生理生化特性及其系统发育
[J].
Changes of the runoff and its components in Urumqi Glacier No.1 catchment, Tianshan Mountains, 1959-2017
[J].
1959-2017年天山乌鲁木齐河源1号冰川流域径流及其组分变化
[J].
Characteristics of the culturable bacteria in the surface and deep layers of the Tanggula Hariqin ice core, Tibetan Plateau
[J].
藏高原唐古拉哈日钦冰芯表层和深层可培养细菌特征
[J].
Revealing microbial processes and nutrient limitation in soil through ecoenzymatic stoichiometry and glomalin-related soil proteins in a retreating glacier forefield
[J].
Yeasts from glacial ice of Patagonian Andes, Argentina
[J].
Microbial ecology of mountain glacier ecosystems: biodiversity, ecological connections, and implications of a warming climate
[J].
Habitat-specificity and diversity of culturable cold-adapted yeasts of a cold-based glacier in the Tianshan Mountains, northwestern China
[J].
Composition and phylogeny of fungal community in supraglacial cryoconite and subglacial sedments of the Glacier No.1 at headwaters of the Urumqi River in Tianshan Mountains
[J] .
天山乌源1号冰川表面冰尘及底部沉积层真菌群落结构比较及其系统发育分析
[J].
Phylogeny and diversity of culturable yeasts in supraglacial cryoconite and subglacial sedments of the Glacier No.1 in Tianshan Mountains
[J] .
天山一号冰川表面冰尘和底部沉积层中可培养酵母菌系统发育类群的分布及生态生理特征
[J].
Differentiation of Acidithiobacillus ferrooxidans and A. thiooxidans strains based on 16S-23S rDNA spacer polymorphism analysis
[J].
Study of molecular epidemiology of candidiasis in Portugal by PCR fingerprinting of Candida clinical isolates
[J].
MEGA7: molecular evolutionary genetics analysis Version 7.0 for bigger datasets
[J].
Decreasing soil microbial diversity is associated with decreasing microbial biomass under nitrogen addition
[J].
Taxonomic assessment and enzymes production by yeasts isolated from marine and terrestrial Antarctic samples
[J].
Psychrophilic yeasts in glacial environments of Alpine glaciers
[J].
Taxonomy and richness of yeasts associated with angiosperms, bryophytes, and meltwater biofilms collected in the Antarctic Peninsula
[J].
Isolation of oligotrophic yeasts from supraglacial environments of different altitude on the Gulkana Glacier (Alaska)
[J].
Identification and characterization of yeasts isolated from the South Shetland Islands and the Antarctic Peninsula
[J].
Microbial primary production on an Arctic glacier is insignificant in comparison with allochthonous organic carbon input
[J].
Red yeasts and carotenoid production: outlining a future for non-conventional yeasts of biotechnological interest
[J].
Rhodotorula psychrophila sp. nov., Rhodotorula psychrophenolica sp. nov. and Rhodotorula glacialis sp. nov., novel psychrophilic basidiomycetous yeast species isolated from alpine environments
[J].
The yeasts: a taxonomic study
[J].
The microbiome of glaciers and ice sheets
[J].
Patterns and processes of microbial community assembly
[J].
Seasonal change in bacterial flora and biomass in mountain snow from the Tateyama Mountains, Japan, analyzed by 16S rRNA gene sequencing and real-time PCR
[J].
Microbial communities and primary succession in high altitude mountain environments
[J].
Seasonal and plant-dependent variations in diversity, abundance and stress tolerance of epiphytic yeasts in desert habitats
[J].
Yeast biogeography and the effects of species recognition approaches: the case study of widespread basidiomycetous species from Birch Forests in Russia
[J].
Detection and characterization of ancient fungi entrapped in glacial ice
[J].
Psychrophilic yeasts from worldwide glacial habitats: diversity, adaptation strategies and biotechnological potential
[J].
High microbial activity on glaciers: importance to the global carbon cycle
[J].
Yeast and yeast-like diversity in the southernmost glacier of Europe (Calderone Glacier, Apennines, Italy)
[J].
Niche partitioning among prochlorococcus ecotypes along ocean-scale environmental gradients
[J].


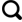



 甘公网安备 62010202000676号
甘公网安备 62010202000676号